蛋白质二级结构
编辑蛋白质结构的互动图,以PCNA为例。(PDB:1AXC)蛋白质二级结构是蛋白质局部片段的三维形式。两个最常见的二级结构元素是α螺旋和β片,尽管也有β转折和欧米茄环。二级结构元素通常是在蛋白质折叠成其三维三级结构之前自发形成的一种中间物。二级结构是由肽骨架中的氨基氢原子和羧基氧原子之间的氢键模式正式定义的。二级结构也可以根据拉马钱德兰图中某一特定区域的骨架二面角的规律模式来定义,而不管它是否有正确的氢键。二级结构的概念于1952年在斯坦福大学首次提出。其他类型的生物聚合物,如核酸,也拥有特征性的二级结构。
蛋白质二级结构的类型
编辑蛋白质二级结构中氢键的互动图。上面的漫画,下面的原子,氮为蓝色,氧为红色(PDB:1AXC)最常见的二级结构是α螺旋和β片。其他的螺旋,如310螺旋和π螺旋,经计算具有能量上有利的氢键模式,但在天然蛋白质中很少观察到,除非是在α螺旋的末端,因为螺旋中心的骨架包装不利。其他的延伸结构,如多肽螺旋和α片,在原生状态的蛋白质中很少见,但经常被假设为重要的蛋白质折叠中间产物。紧密的转折和松散、灵活的环状结构将更多的规则二级结构元素联系起来。随机线圈不是一个真正的二级结构,但却是表明没有规则二级结构的一类构象。氨基酸在形成各种二级结构元素的能力上有所不同。脯氨酸和甘氨酸有时被称为螺旋体破坏者,因为它们破坏了α螺旋骨架构象的规则性;然而,两者都有不寻常的构象能力,并且常见于轮回中。在蛋白质中喜欢采用螺旋构象的氨基酸包括蛋氨酸、丙氨酸、亮氨酸、谷氨酸和赖氨酸(氨基酸1字母代码中的MALEK);相比之下,大的芳香族残基(色氨酸、酪氨酸和苯丙氨酸)和Cβ支链氨基酸(异亮氨酸、缬氨酸和苏氨酸)喜欢采用β链构象。然而,这些偏好还不足以产生一种可靠的方法,仅从序列上预测二级结构。低频集体振动被认为对蛋白质内部的局部刚度很敏感,揭示出β结构一般比α或无序蛋白质的刚度大。中子散射测量已将~1THz的光谱特征与β-桶状蛋白GFP二级结构的集体运动直接联系起来。二级结构中的氢键模式可能是明显扭曲的,这使得二级结构的自动测定变得困难。有几种正式定义蛋白质二级结构的方法(如:DSSP、DEFINE、STRIDE、ScrewFit、SST)。
DSSP分类
编辑蛋白质二级结构词典,简称DSSP,常用单字母代码来描述蛋白质二级结构。二级结构是根据Pauling等人在1951年(在任何蛋白质结构被实验确定之前)最初提出的氢键模式来分配的。DSSP定义的二级结构有八种类型。G=3圈螺旋线(310螺旋线)。最小长度为3个残基。H=4圈螺旋线(α螺旋线)。最小长度为4个残基。
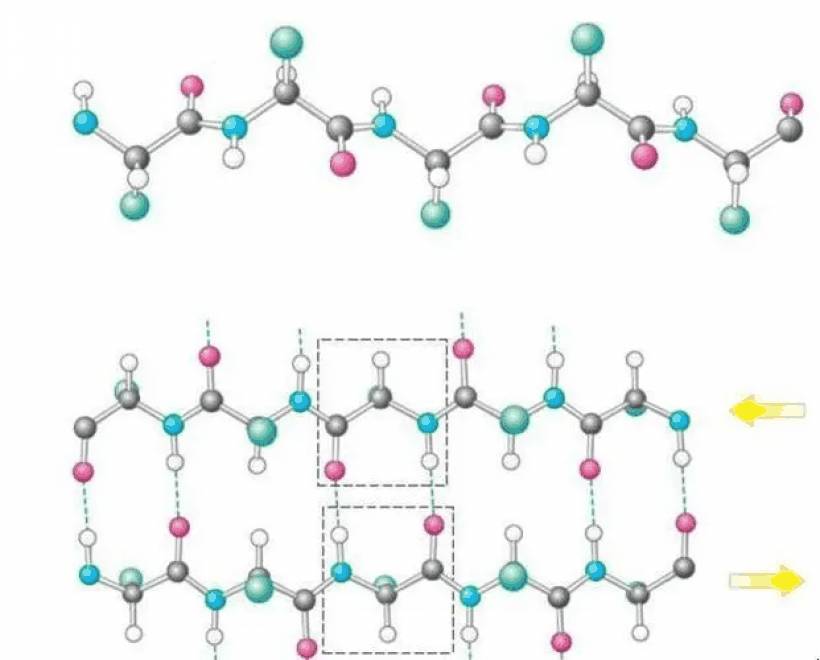
I=5圈螺旋(π螺旋)。最小长度为5个残基。T=氢键圈(3、4或5圈)E=平行和/或反平行的β-片状结构的延伸链。最小长度为2个残基。B=孤立的β桥中的残基(单对β-sheet氢键的形成)S=弯曲(唯一非基于氢键的分配)。C=螺旋(不在上述任何构象中的残基)。”螺旋”通常被编码为”(空格)、C(螺旋)或’-‘(破折号)。螺旋(G、H和I)和片状构象都需要有一个合理的长度。这意味着一级结构中2个相邻的残基必须形成相同的氢键模式。如果螺旋或片状氢键模式太短,它们将被分别指定为T或B。还存在其他的蛋白质二级结构分配类别(急转弯、欧米茄环等),但它们使用的频率较低。二级结构是由氢键定义的,所以氢键的确切定义是至关重要的。二级结构的标准氢键定义是DSSP的定义。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/160920/
