乙烯
编辑化学式C2H4 摩尔质量28.054 g·mol−1外观无色气体密度1.178 kg/m3 at 15 °C, gasMelting point−169.2 °C (−272.6 °F; 104.0 K)沸点− 103.7 °C (−154.7 °F; 169.5 K)水中溶解度0.131 mg/mL (25 °C); 2.9 mg/L乙醇溶解度4.22 mg/L乙醚溶解度良好酸度(pKa)44共轭酸乙烯磁化率(χ)-15.30·10−6 cm3/mol粘度10.28 μPa·s
分子形状D2h偶极矩为零
标准摩尔熵 (S⦵298)219.32 J·K−1·mol−1标准生成焓 (ΔfH⦵298)+52.47 kJ/mol
危害
H220, H336 防范说明 P210, P261, P271, P304+P340, P312, P377, P381, P403, P403+P233, P405, P501NFPA 704(火钻石)242闪点−136°C (−213°F); 136 自燃温度 542.8 °C (1,009.0 °F; 815.9 K)
相关化合物
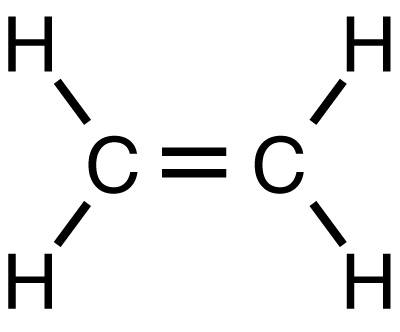
乙烯(IUPAC 名称:乙烯)是一种碳氢化合物,其分子式为 C2H4 或 H2C=CH2。它是一种无色易燃气体,纯净时带有淡淡的甜味和麝香气味。 它是最简单的烯烃(具有碳碳双键的碳氢化合物)。
<SPan style=”color: #262626;font-family: var(–theme-font-family)”>乙垢广泛用于化学工业,其全球产量(2016 年超过 1.5 亿吨)超过任何其他有机化合物。 大部分生产用于聚乙烯,这是一种广泛使用的塑料,含有各种链长的乙烯单元的聚合物链。 乙倦也是一种重要的天然植物激素,在农业上用于催熟果实。 乙烯的水合物是乙醇。
结构和性质
编辑这种碳氢化合物有四个氢原子与一对通过双键连接的碳原子结合。 构成乙烯的所有六个原子都是共面的。 H-C-H 角为 117.4°,接近理想 sp² 杂化碳的 120°。 该分子也相对较弱:围绕 C-C 键旋转是一个能量非常低的过程,需要通过在 50°C 下提供热量来破坏 π 键。
乙烯分子中的 π 键决定了其有用的反应性。 双键是电子密度高的区域,因此容易受到亲电子试剂的攻击。 乙烯的许多反应都是由过渡金属催化的,过渡金属使用 π 和 π* 轨道瞬时与乙烯结合。
作为一个简单的分子,乙烯在光谱上是简单的。 其紫外-可见光谱仍被用作理论方法的检验。
使用
编辑乙烯的主要工业反应按规模顺序包括:1) 聚合,2) 氧化,3) 卤化和氢卤化,4) 烷基化,5) 水合,6) 低聚,和 7) 加氢甲酰化。 在美国和欧洲,大约90%的乙烯用于生产环氧乙烷、二氯乙烷、乙苯和聚乙烯。 大多数与乙烯的反应是亲电加成。
聚合
编辑聚乙烯消耗了世界一半以上的乙烯供应。 聚乙烯,又称聚乙烯、聚乙烯,是世界上应用最广泛的塑料。 它主要用于制作包装薄膜、手提袋和垃圾袋。 通过低聚(短聚合物的形成)产生的线性 α-烯烃用作前体、洗涤剂、增塑剂、合成润滑剂、添加剂,也用作聚乙烯生产中的共聚单体。
氧化
编辑乙烷被氧化生成环氧乙烷,环氧乙烷是乙氧基化生产表面活性剂和洗涤剂的关键原料。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/208363/
