氯气(Chlorine),是氯元素形成的一种单质,化学式为Cl2,是一种有强烈刺激性的有毒黄绿色气体,有窒息性臭味,对呼吸器官有强烈的刺激性。其微溶于水,易溶于四氯化碳、二硫化碳等有机溶剂中;是一种强氧化剂,在空气中不燃烧,但能助燃,且能与大多数元素或化合物反应,在日光下与其他易燃气体混合时会发生燃烧或爆炸,也能与乙炔、松节油、乙醚、氨、烃类、大多数塑料及某些金属粉末剧烈反应,发生爆炸生成爆炸性产物。
研究历史
编辑1774年,瑞典杰出的化学家卡尔・威尔海姆・舍勒发现了氯气。他研究软锰矿(主要成分是MnO2)时发现,如果把浓盐酸倒入盛有“这种黑色粉末”的烧瓶里并加热时,便会生成一种窒息的、使肺部极为难受的黄绿色气体。舍勒称这种气体为“无燃素的盐酸”。氯虽被发现了,但当时不认为是新元素。1807年,英国化学家戴维对这种气体进行了仔细的研究,他通过磷与氯的作用,确证氯是一种元素。1823年,氯气第一次被英国科学家法拉第所液化。
物化性质
编辑物理性质
氯气,相对分子质量70.9,熔点-101 ℃,沸点-34.04 ℃,相对蒸气密度(空气为1)2.49,亨利定律常数时为 0104.25 Pa·m/mol(0 °C) ,外观呈黄绿色,是有强烈刺激性气味,比空气重,易液化,微溶于水,1体积水溶解2体积的氯气,易溶于四氯化碳、二硫化碳等有机溶剂。
化学性质
氯气有毒,有剧烈的刺激性,溶于水会生成盐酸和次氯酸。氯气的化学性质很活泼,是一种活泼的非金属单质,和金属、非金属、有机物、碱等都可以发生反应。
与水反应
氯气可溶于水,遇水后会生成次氯酸和盐酸,而次氯酸有强氧化性,具有漂白性,同时也有消毒作用。
与金属反应
与金属钠的反应:
与金属铜的反应:
与非金属反应
与氢气反应:
与磷的反应:
与有机物反应
与甲烷反应:
与乙烷反应:
与乙炔反应:
与苯发生取代反应:

与碱反应
氯气与碱溶液反应,生成次氯酸盐、金属氯化物和水,由于次氯酸盐比次氯酸稳定,容易保存,故工业上常用氯气和消石灰作用制取漂白粉(也称含氯石灰),其反应如下:
氯气与消石灰反应的实验室装置图
制备方法
编辑舍勒法
此工艺由瑞典化学家舍勒发明,将二氧化锰与浓盐酸反应制得氯气,但由于需要大量盐酸,此法仅限于实验室制取氯气,其反应方程式如下:
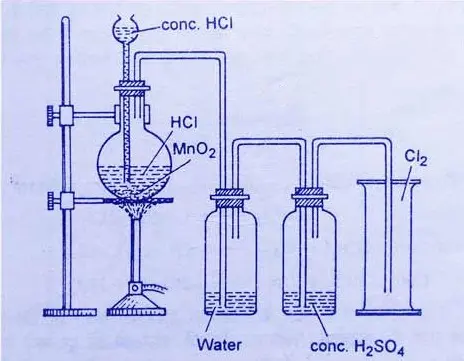
舍勒法制备氯气示意图
贝托雷法
法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,加热制得氯气,其反应方程式如下:
狄肯法
狄肯和洪特发明了以氯化铜为催化剂,加热时用空气中的氧气来氧化氯化氢气体制取氯气的方法,反应方程式如下:
电解法
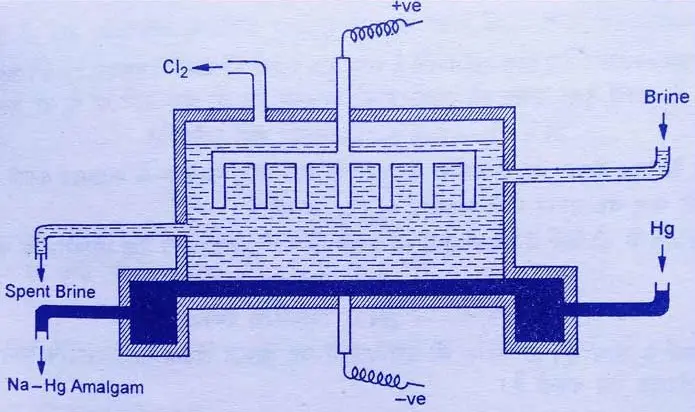
电解法(索尔维法)制备氯气示意图
应用领域
编辑自来水消毒
自来水消毒多采用氯气和漂白粉。液氯主要用于城市自来水的消毒;次氯酸是一种很强的氧化剂,能杀死水中的细菌,所以常用氯气来消毒饮用水;次氯酸还能使染料氧化成无色的化合物,使其褪色,所以氯气可以用作布匹和纸等的漂白剂;工业上用氯气和消石灰作用来制取漂白粉,漂白粉是带有与氯气相似刺激性气味的白色粉末,具有极强的氧化性,受光受热易分解,放人水中后也能分解产生少量的次氯酸,次氯酸再分解便放出氧气,漂白粉比较稳定,容易保存。
化工领域
氯气是一种重要的化工原料,除用于制作液氯、盐酸及漂白消毒系列,还可制造一系列无机氯产品(如无机氯化物氯化铝、氯化铵、氯化锌等),也可制造氯仿、四氯化碳等有机溶剂。次氯酸钠、液氯等用于纸浆及棉纤维、化学纤维的漂白,氯化纸浆的制造;还用于气体冶炼,将一些元素的矿物制得氯化物,然后还原成产品,制造无机及有机氯化物等。
电子领域
氯气可用于干法蚀刻、集成电路、光纤、等方面的应用;高纯氯用作半导体材料的气体刻蚀剂,特别是与三氯化硼一起时可用于铝的刻蚀。还可用于MCVD、VAD、PCVD等三种制造中以及半导体生产中的晶体生长、热氧化学工艺中。
其他行业
氯气在医药上具有广泛的应用,可用于合成一些常参与含氯药物,如马来酸氨氯地平片、氯磺丙脲等;氯气也可应用于冶金工业,生成金属镁等;还可用于合成农药,用于制造某些高效低毒的有机含氯农药,如速灭威、含氯菊酯等。
马来酸氨氯地平片
安全事宜
编辑储存与运输
氯气应储放在低温、通风场所,防止日晒;与易燃气体、金属粉末、氨气钢瓶分开储存。装运时要捆扎牢固,防止滚动,搬运时轻拿轻放,切勿损坏钢瓶及瓶阀。
毒理学
空气中氯气最高允许浓度为2 mg/m,如空气中氯气浓度达200 mg/m,人暴露其中1分钟即可致死。
健康安全
氯气为黄绿色有强烈刺激性的气体,可溶于水,与水生成次氯酸和盐酸,次氯酸再分解成氧气、氯气和氯酸,对黏膜有刺激和氧化作用,导致黏膜充血、水肿和坏死。低浓度时仅作用于眼和上呼吸道,高浓度时除以上外还作用于下呼吸道,极高浓度时可刺激迷走神经,引起反射性心搏骤停。吸入少量氯气会使鼻、喉等黏膜受到刺激而发炎,引起胸部疼痛和咳嗽,吸入大量氯气会中毒致死;实验室内嗅闻氯气时,应用手轻轻在氯气瓶口扇动,只使极少量的氯气飘入鼻孔。

氯气图片
环境危害
氯气是破坏臭氧层的主要单质之一,氯气会分解臭氧分子,而氯原子在阳光下又会与臭氧分子发生化学反应,破坏臭氧分子。氯气对植物也有一定的危害,氯气进入植物组织后,与水作用生成次氯酸,它是强氧化剂,有较大的破坏作用,对叶肉细胞有很强的杀伤力,能很快破坏叶绿素,使叶片产生褪色伤斑,严重时使全叶漂白、枯卷,甚至脱落。
泄漏现场氯气中毒预防措施
1.发生氯气泄漏后,要做好个体防护工作,如配戴防毒面具、防毒口罩、氧气呼吸器,穿防化衣,用湿毛巾或湿衣物捂住口鼻等。2.做好个体防护的同时向上风向疏散,不要在低洼处滞留。3.若吸入少量氯气,可用碳酸氢钠溶液漱口,若吸入过多的氯气,立即送往医院治疗。4.应急抢险人员做好个体防护的同时进行氯气捕消和堵漏,防止事故扩大,并且要两人以上同行,不得单独行动。5.按照事故泄漏量的大小设置隔离区,防止无关人员进入导致中毒事故。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗,并迅速进行医务处理。眼睛接触:提起眼睑,立即用流动清水或生理盐水冲洗至少15分钟,并迅速进行医务处理。吸入:必须将人员移到空气清新处,若呼吸困难,给予吸氧,若停止呼吸,则人工呼吸。吸入后有症状者至少观察12h,对症处理。吸入量较多者应卧床休息,吸氧,及时进行医务处理。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587269/
