什么是微电极阵列
编辑微电极阵列(MEA)(也称为多电极阵列)是包含多个(数万到数千个)微电极的设备,通过这些微电极获取或传递神经信号,本质上充当将神经元连接到电子电路的神经接口。有两类一般的微电极阵列:可植入的MEA,用于体内,和不可植入的MEA,用于体外。
微电极阵列的类型
编辑微电极阵列可根据其潜在用途分为子类别:体外和体内阵列。
体外阵列
标准类型的体外微电极阵列采用8×8或6×10电极的模式。电极通常由氧化铟锡或钛组成,直径在10到30μm之间。这些阵列通常用于单细胞培养或急性脑切片。
体外MEA面临的一个挑战是使用使用高功率透镜的显微镜对它们进行成像,需要微米量级的低工作距离。为了避免这个问题,已经使用盖玻片创建了“薄”-MEA。这些阵列约为180μm,可用于高倍率镜头。
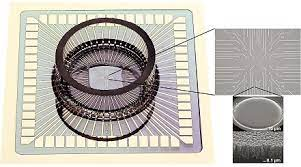
在另一个特殊设计中,60个电极被分成6×5的阵列,间距为500μm。一组内的电极间隔30微米,直径为10微米。诸如此类的阵列用于检查神经元的局部反应,同时还研究器官切片的功能连接性。
空间分辨率是MEA的主要优势之一,当使用高密度MEA时,它允许以更高的精度获取远距离发送的信号。这些阵列通常具有256个电极的方形网格图案,覆盖面积为2.8×2.8mm。
基于CMOS的高密度微电极阵列提供了更高的空间分辨率,该阵列具有数千个电极以及集成读出和刺激电路,位于缩略图大小的紧凑芯片上。甚至已经证明了沿单个轴突传播的信号的分辨率。
为了获得高质量的信号,电极和组织必须彼此紧密接触。穿孔的微电极阵列设计将负压施加到基板上的开口,以便组织切片可以定位在电极上以增强接触和记录信号。
降低电极阻抗的另一种方法是通过修改界面材料,例如通过使用碳纳米管,或通过修改电极结构,例如使用金纳米柱或纳米腔。
体内阵列
可植入MEA的三大类是微线、硅基和柔性微电极阵列。微丝MEA主要由不锈钢或钨制成它们可用于通过三角测量来估计单个记录神经元的位置。基于硅的微电极阵列包括两个特定模型:密歇根和犹他阵列。密歇根阵列允许更高密度的植入传感器以及比微线MEA更高的空间分辨率。它们还允许沿着柄的长度获得信号,而不仅仅是在柄的末端。
与密歇根阵列相比,犹他阵列是3D的,由100个导电硅针组成。然而,在犹他州阵列中,仅从每个电极的尖端接收信号,这限制了一次可以获得的信息量。
此外,犹他州阵列的制造具有设定的尺寸和参数,而密歇根州阵列允许更多的设计自由度。灵活的阵列,由聚酰亚胺、聚对二甲苯或苯并环丁烯比刚性微电极阵列更具优势,因为它们提供了更紧密的机械匹配,因为硅的杨氏模量远大于脑组织的杨氏模量,从而导致剪切引起的炎症。
数据处理方法
编辑神经元交流的基本单位至少是动作电位。这种全有或全无的现象起源于轴突小丘,导致细胞内环境去极化,沿轴突传播.这种通过细胞膜的离子通量会在细胞外环境中产生急剧的电压变化,这是MEA电极最终检测到的。
因此,电压尖峰计数和分类通常用于研究表征网络活动。与电压测量相比,尖峰列车分析还可以节省处理时间和计算内存。
尖峰时间戳被识别为单个电极测量的电压超过阈值的时间(通常由非活动时间段平均值的标准偏差定义)。可以进一步处理这些时间戳以识别突发(近距离的多个尖峰)。对这些列车的进一步分析可以揭示尖峰组织和时间模式。
能力
编辑微电极阵列的优势
一般来说,与更传统的方法(如膜片钳)相比,体外阵列的主要优势包括:
- 允许一次放置多个电极而不是单独放置
- 在相同的实验设置中设置控制的能力(通过使用一个电极作为控制,其他电极作为实验)。这在刺激实验中特别有趣。
- 能够在阵列中选择不同的记录位置
- 能够同时从多个站点接收数据
- 来自完整视网膜的记录非常有趣,因为它可以提供实时光学刺激,例如,可以重建感受野。
此外,与膜片钳相比,体外阵列是非侵入性的,因为它们不需要破坏细胞膜。
然而,就体内阵列而言,与膜片钳相比的主要优势是高空间分辨率。可植入阵列允许从单个神经元获得信号,从而获得可用于控制假肢装置的运动位置或速度等信息。
在动物行为过程中,至少在啮齿动物中,可以使用数十个植入电极进行大规模并行记录。这使得这种细胞外记录成为识别神经回路和研究其功能的首选方法。然而,使用多电极细胞外阵列明确识别记录的神经元仍然是一个问题。
微电极阵列的缺点
与膜片钳和动态钳系统相比,体外多边环境协定不太适合记录和刺激单细胞,因为它们的空间分辨率较低。与动态钳的能力相比,MEA电极可以有效传输到其他细胞的信号的复杂性是有限的。
微电极阵列的植入也有几种生物学反应,特别是在慢性植入方面。这些影响中最值得注意的是神经元细胞丢失、神经胶质瘢痕和功能电极数量的减少。
组织对植入的反应取决于许多因素,包括MEA小腿的大小、小腿之间的距离、MEA材料成分和插入时间段。组织反应通常分为短期反应和长期反应。短期反应发生在植入后数小时内,并以设备周围的星形胶质细胞和神经胶质细胞数量增加开始。
招募的小胶质细胞然后引发炎症并开始吞噬异物的过程。随着时间的推移,被招募到设备中的星形胶质细胞和小胶质细胞开始积累,在阵列周围形成一个鞘,在设备周围延伸数十微米。这不仅增加了电极探针之间的空间,而且使电极绝缘并增加了阻抗测量。阵列长期植入的问题一直是这些设备研究的驱动力。
一项新的研究检查了慢性植入引起的炎症的神经退行性影响。免疫组织化学标记显示出令人惊讶的过度磷酸化牛磺酸<SPan style=”font-family: var(–theme-font-family);color: #262626″> (tau) 蛋白的存在,这是阿尔茨海默病的一个指标,靠近电极记录部位。
电极材料的吞噬作用也引发了对生物相容性反应的质疑,研究表明这种反应很小,在体内12周后几乎不存在。将器械插入的负面影响降至最低的研究包括用促进神经元附着的蛋白质(如层粘连蛋白或药物洗脱物质)对器械进行表面涂层。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/134399/
