疏水作用
编辑疏水效应是观察到的非极性物质在水溶液中聚集并排除水分子的趋势。疏水这个词的字面意思是怕水,它描述了水和非极性物质的分离,它使水分子之间的氢键最大化,并使水和非极性分子之间的接触面积最小化。在热力学方面,疏水效应是溶质周围水的自由能变化。周围溶剂的正自由能变化表示疏水性,而负自由能变化表示亲水性。疏水作用负责将油和水的混合物分离成两种成分。它还负责与生物学相关的影响,包括:细胞膜和囊泡形成、蛋白质折叠、膜蛋白插入非极性脂质环境和蛋白质-小分子结合。因此,疏水效应对生命至关重要。观察到这种效应的物质称为疏水物。
两亲物
编辑两亲物是同时具有疏水和亲水结构域的分子。洗涤剂由两亲物组成,它们通过形成胶束和双层(如肥皂泡)使疏水性分子溶解在水中。它们对于由两亲性磷脂组成的细胞膜也很重要,可防止细胞的内部水环境与外部水混合。
大分子的折叠
编辑在蛋白质折叠的情况下,疏水效应对于理解在蛋白质中聚集在一起的疏水氨基酸(如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸和蛋氨酸)的结构很重要。水溶性蛋白质的结构具有疏水核心,其中侧链被水掩埋,从而稳定了折叠状态。带电和极性侧链位于暴露于溶剂的表面上,在那里它们与周围的水分子相互作用。尽量减少暴露于水的疏水侧链的数量是折叠过程背后的主要驱动力,尽管蛋白质内氢键的形成也稳定了蛋白质结构。除了负责序列选择性的Watson-Crick碱基配对和芳香碱基之间的堆叠相互作用外,DNA三级结构组装的能量学被确定为由疏水效应驱动。
蛋白质纯化
编辑在生物化学中,疏水效应可用于根据疏水性分离蛋白质混合物。使用疏水性固定相(如苯基琼脂糖)的柱层析会导致疏水性更强的蛋白质移动得更慢,而疏水性较低的蛋白质会更快地从色谱柱中洗脱出来。为了获得更好的分离效果,可以添加盐(更高浓度的盐会增加疏水效果),随着分离的进行,其浓度会降低。
疏水作用的原因
编辑疏水效应的起源尚不完全清楚。一些人认为,疏水相互作用主要是一种熵效应,源于非极性溶质破坏液态水分子之间的高动态氢键。大分子的烃链或类似的非极性区域不能与水形成氢键。将这种非氢键表面引入水中会破坏水分子之间的氢键网络。氢键与该表面相切重新定向,以最大限度地减少水分子的氢键3D网络的破坏,这导致非极性表面周围的结构化水笼。形成笼子(或包合物)的水分子的流动性受到限制。在小的非极性颗粒的溶剂化壳中,限制量约为10%。例如,在室温下溶解氙的情况下,已发现30%的迁移率限制。在较大的非极性分子的情况下,溶剂化壳中水分子的重新定向和平移运动可能会受到2到4倍的限制;因此,在25°C时,水的重新定向相关时间从2皮秒增加到4-8皮秒。通常,这会导致水分子的平移和旋转熵的显着损失,并使该过程在系统中的自由能方面不利。
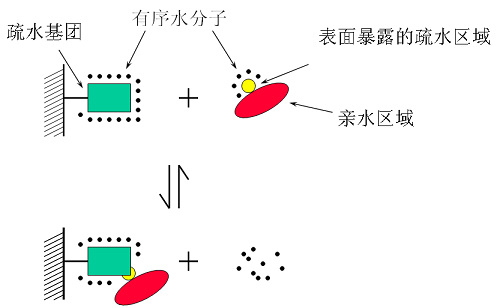
通过聚集在一起,非极性分子减少了暴露于水的表面积并将其破坏性影响降至最低。溶剂化壳中水分子的重新定向和平移运动可能会受到2到4倍的限制;因此,在25°C时,水的重新定向相关时间从2皮秒增加到4-8皮秒。通常,这会导致水分子的平移和旋转熵的显着损失,并使该过程在系统中的自由能方面不利。通过聚集在一起,非极性分子减少了暴露于水的表面积并将其破坏性影响降至最低。溶剂化壳中水分子的重新定向和平移运动可能会受到2到4倍的限制;因此,在25°C时,水的重新定向相关时间从2皮秒增加到4-8皮秒。通常,这会导致水分子的平移和旋转熵的显着损失,并使该过程在系统中的自由能方面不利。通过聚集在一起,非极性分子减少了暴露于水的表面积并将其破坏性影响降至最低。这导致水分子的平移和旋转熵的显着损失,并使该过程在系统中的自由能方面不利。通过聚集在一起,非极性分子减少了暴露于水的表面积并将其破坏性影响降至最低。这导致水分子的平移和旋转熵的显着损失,并使该过程在系统中的自由能方面不利。通过聚集在一起,非极性分子减少了暴露于水的表面积并将其破坏性影响降至最低。疏水效应可以通过测量非极性分子在水和非极性溶剂之间的分配系数来量化。分配系数可以转换为包括焓和熵分量的传递自由能,ΔG=ΔH-TΔS。这些成分是通过量热法实验确定的。发现疏水效应在室温下是熵驱动的,因为水分子在非极性溶质的溶剂化壳中的流动性降低;然而,发现转移能的焓分量是有利的,这意味着由于水分子的流动性降低,它加强了溶剂化壳中的水-水氢键。在更高的温度下,当水分子变得更加移动时,这种能量增益随着熵分量的增加而减少。疏水作用可以通过将溶剂化的自由能与本体水进行比较来计算。这样,疏水效应不仅可以局部化,而且可以分解为焓和熵的贡献。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/151128/
