在电化学反应器中,电极处于“心脏”电位。电极是电化学反应接受或供给电子的场所,而且其电极电位的变化还制约着电子转移反应的方向和限度。
电极介绍
编辑电池 的组成部分,它由一连串相互接触的物相构成,其一端是电子导体──金属(包括石墨)或半导体,另一端必须是离子导体──电解质(这里专指电解质溶液,简称“电解液”或“电液”)。结构最简单的电极应包括两个物相和一个相界面,即〔金属|电液〕。上述定义的电极也称“半电池”。电极的概念是M.法拉第 进行系统电解实验后在1834年提出的,原意只指构成电池的插在电液中的金属 棒。

电极表达式
编辑书刊上表达电极的方式很不一致,这里采用的方式是:写下各串联的物相,每一相界面用一个隔离线表示。如铜电极写成Cu|CuSO4 (1Μ,水溶液)或Cu|Cu;甘汞电极写成Hg|Hg2Cl2 |Cl;在水溶液中的钝化的铁电极可写成Fe|Fe3O4|Fe2O3 |水溶液。电极方块图把电极的各个相用分隔的方块表达,便于标明各相界面上的反应,有助于理解电极上发生的实际过程。
电极的命名
编辑命名方式很复杂,有些根据电极的金属部分命名,如铜电极、铂电极等;有些根据电极活性的氧化还原对中的特征物质命名,如甘汞电极、氢电极;有些根据电极金属部分的形状命名,如滴汞电极、转盘电极;有些根据电极的功能命名。这些名称如参比电极、钠离子选择电极(见离子选择性电极)等,都是约定俗成的。
电极分类
编辑按材料分
1. 金属电极,如铜电极(如右图),其特点是氧化还原对可以迁越相界面。
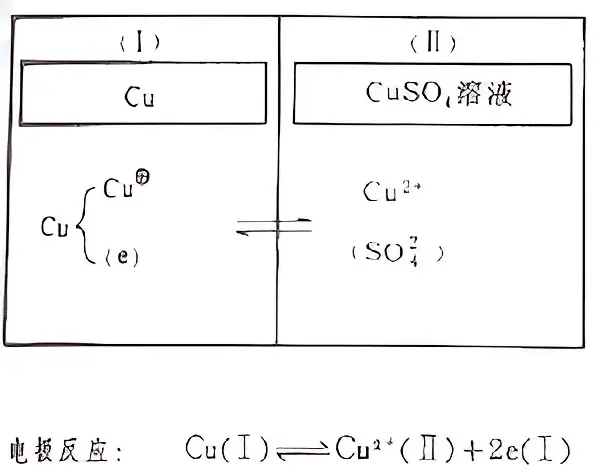
铜电极
2. 膜电极:利用隔膜对于单种离子的透过性或膜表面与电解液的离子交换平衡所建立的电势来测量电液中特定离子活度的装置(如右下图),例如玻璃电极、离子选择性电极。
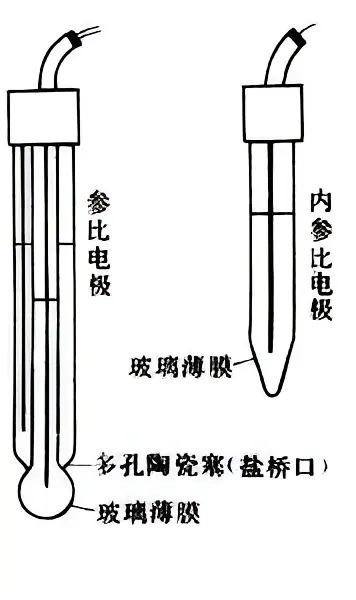
膜电极
3. 微电极:工作面积很小的电极。电极面积大小的界限并不十分严格。微电极包括两种涵义:①指电极的微型化。②指在电化学分析中电极面积很小但整个电极并非微型化的一类电极。4.化学修饰电极:利用吸附、涂敷、聚合、化学反应等方法把活性基团、催化物质等附着在电极金属(包括石墨、半导体)表面上,使之具有较强的特征功能。这是70年代以来电极制备方法的新发展。 5.气体电极,是氧化还原对的一个组分为气体时的氧化还原电极,例如氢电极 (Pt|H2|H)、氯电极(Pt|Cl2|Cl)等。为了加速达成平衡,金属铂上需要镀上铂黑以增加表面积并起电催化作用。6.难溶盐电极,氧化还原对的一个组分是难溶盐或其他固相。因此它包含三个物相、两个界面,在每一相界面上存在着单一的快速迁越过程,如甘汞电极(Hg|Hg2Cl2|Cl)、氧化汞电极(Hg|HgO|OH)。在甘汞电极中,甘汞与电解液的溶解平衡完全受电液中浓度较高的Cl所控制,Cl在Hg2Cl2|电液界面上的交换速率也很快,故它的电极电势非常稳定。它是最常用的参比电极,有些书刊称这类电极为第二类电极。
按作用分
1.指示电极:是指对溶液中参与半反应的离子的活度或不同氧化态的离子的活度能产生能斯特响应的电极。是电化学分析法中所用的工作电极。它和另一对应电极或参比电极组成电池,通过测定电池的电动势或在外加电压的情况下测定流过电解池的电流,即可得知溶液中某种离子的浓度。根据功能不同,指示电极可分为电势型和电流型两大类。属于电势型的有电位法和电位滴定法中所用的各种电极,其中常用的是各类离子选择性电极。在电位法中,利用测定电池的电动势,即可由能斯特公式推知在指示电极上发生反应的离子浓度。属于电流型的有极谱法和伏安法或安培滴定法中所用的滴汞电极和各种固体微电极以及库仑滴定中所用的铂电极等。在极谱法和伏安法中,由于指示电极面积极小,电极反应时发生极化作用,由微电极指示出的扩散电流和离子浓度的线性关系即可测知溶液中离子的浓度。 2.工作电极:工作电极是指在测试过程中可引起试液中待测组分浓度明显变化的电极,如电解和库仑分析法中的铂电极。3.参比电极:电位具有稳定性和重现性的电极。可以用它作为基准来测量其他电极的电位。常用的参比电极有氢电极、甘汞电极、银|氯化银电极、汞|氧化汞电极、汞|硫酸亚汞电极。4.辅助电极:也叫对电极,它只用来通过电流以实现研究电极的极化。研究阴极过程时,辅助电极作阳极,而研究阳极过程时,辅助电极作阴极。辅助电极的面积一般比研究电极大,这样就降低了辅助电极上的电流密度,使其在测量过程中基本上不被极化,因而常用铂黑电极作辅助电极,也可以使用在研究介质中保持惰性的金属材料如Ag、Ni、W、Pb等;在特定情况下有时使用特定电极。有时为了测量简便,辅助电极也可以用与研究电极相同的金属制作。
按性质分
1.极化电极:在可逆电池的情况下,整个电池处于电化学平衡状态,两个电极也分别处于平衡状态,电极电位是由能斯特方程决定的,是平衡的电极电位。此时,通过电极的电流为零,即电极反应的速率为零。若要使一个不为零的电流通过电极,电极电位必须偏离平衡电极电位的值,这个就称为极化电极。2.去极化电极:电极电位在电解过程中保持恒定,不随外加电压的变化而改变,这样的电极成为去极化电极。
按发生电化学反应的数目分
1.单一电极:如果电极的金属│电液界面上只存在一种起主导作用的电极反应,这就是单一电极2.多重电极:如果存在的不只是一种电极反应,就是多重电极。例如锌电极(Zn|ZnSO4水溶液)上可能存在两种电极反应:
(1)
(2)但由于金属锌上的氢超电势很高,反应(2)速率太小,反应(1)是主导的,上述锌电极被认为是单一电极,是典型的可逆电极。当不太纯的锌浸入硫酸中时,反应(1)和(2)的速率都较快,所以【Zn|H2SO4】电极是二重电极,它的静态电势可根据反应(1)和(2)的极化曲线和极化规律来判断。金属腐蚀体系常常是二重电极。多重电极不可能是可逆的实际应用时,被研究的电极称为工作电极W,在电化学分析法中也称指示电极,它的电势可利用与参比电极R组成的二电极测量电池测量。当工作电极需要极化时,则要另用一辅助电极(或称对应电极,用C表示),组成三电极测量电池系统(如右图),以提供可调节的电流。此时为了减少电液中欧姆电位降(IR)对工作电极电势测量的误差,参比电极与电解液连接处应采用毛细管,使之尽量靠近工作电极,称为鲁金毛细管。
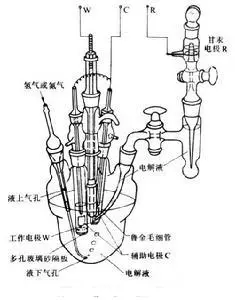
三电极测量电池系统
来源
编辑原电池中的电极电极是原电池的基本组成部分。利用自发氧化还原反应产生电流的装置叫原电池,一个原电池必须由两个基本部分组成:两个电极和电解质溶液。给出电子发生氧化反应的电极,如丹尼尔电池(右图上部所示)中的Zn极,由于其电势较低,被称为负极(negative electrode);而接受电子发生还原反应的一极,如Cu极,由于其电势较高,而称作正极(positive electrode)。根据组成电极物质的状态,可以把电极分为三类。第一类电极是金属电极和气体电极,如丹尼尔电池中锌电极和铜电极,还有标准氢电极;第二类电极是金属-金属难溶盐电极及金属-金属难溶氧化物电极,如Ag-AgCl电极。第三类电极是氧化还原电极(任一电极皆为氧化还原电极,这里所说的氧化还原电极是专指参加电极反应的物质均在同一个溶液中),如Fe3+,Fe2+溶液组成的电极。电解槽中的电极电极是电解过程中,电流进入或离开电解液的导体。电解过程就是在电极相界面上发生氧化还原反应。电极分为阴极和阳极,和电源正极相连的是阳极,阳极上发生氧化反应;和电源负极相连的是阴极,阴极上发生还原反应。电解材料的种类很多,常用的是碳电极,此外钛等金属也可以做电极。在电镀中,含有镀层金属的金属往往作为阳极,待镀制品作为阴极。
最新报道
编辑瑞典林雪平大学、隆德大学和哥德堡大学研究人员利用人体分子作为触发器,首次成功地在活体组织中培育出电极。该研究结果发表在《科学》杂志上。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587271/
