金刚石(英语:diamond),是一种由碳元素组成的矿物,与石墨互为同素异形体,主要分为天然金刚石和人造金刚石两类。碳原子之间以SP³杂化轨道键合形成的立方晶系晶体,为无色透明、高压稳定的超硬材料,与石墨一起构成了碳的代表性同素异形体。其具有较稳定的化学性质,拥有超常的硬度、较好的折射率和耀眼的色彩等特点。可由静态法、动压法、化学气相沉积法等制得人造金刚石。金刚石已广泛应用于机械工业、光学、电子学、珠宝等领域。
发现历史
编辑金刚石,原名来源于希腊文“adams”,即“无敌”之意。最早发现金刚石的国家是印度。在2800多年以前,安得拉戈尔康达王国(现在印度)的克里希纳河,彭纳河和它的分支地区都曾大规模地开采过金刚石。18世纪中期之前,戈尔康达是世界上最大的金刚石供应地。十七世纪中期,巴西在皮奥伊、米纳斯吉拉斯州等地发现了金刚石砂矿床,此后巴西取代了印度,成为世界上金刚石地的主要来源。1866年,南非首次发现金刚石,这是全球金刚石找矿历史上的一个具有历史意义的转变。这颗金刚石是达尼尔雅科布斯(Daniel Jacobs)的女儿在开普省金伯利城以西的霍普敦(Hopetown)附近的奥兰治河(Orange river)边玩耍时发现的。1869年又在南非发现了”南非之星“。此后在南非联邦掀起了寻找金刚石的高潮,先后在奥兰治河及其支流瓦尔河道处发现了多处大规模、高品质的金刚石砂矿,此后数年,南非又多处发现金刚石原生矿床。随后,苏联、澳大利亚、扎伊尔、中国等国家也相继发现金刚石。由于天然金刚石的数量太少,于是人类开始尝试人工合成金刚石。法国化学家莫瓦桑(H.Moissan)认识到将自然界中石墨是在高温高压条件下转化为金刚石,便设计了模仿自然过程的将石墨转化为金刚石的实验。他将多层石墨溶入刚熔化的钢铁,并企图利用将液态的钢铁在迅速冷却之后,当铁变成固态时形成的强大的压力作用下,石墨很快就变成了金刚石。1880年,英国科学家汉内(J.B.Jannay)报导说他将碳氢化合物,骨油和锂的混合物密封于熟铁管中加热到炽热制备出了金刚石。1955年,美国通用电气公司研究发展中心的科学家,本迪(F.R.Bundy)、霍尔(H.T.Hall)等人做出了突出贡献,他们的方法克服高温高压工程、材料、测试等诸多困难,首次成功地将石墨与含碳物质在金属熔体中转变成金刚石。
成因与分布情况
编辑天然金刚石成因
岩层底部为热态和氧逸度差异显著的地区。因此,这一区域是一个理想的区域,这里的平衡气体成分会发生向上迁移而出现不均衡。金刚石的成核过程需要甲烷的氧化或二氧化碳的还原,在岩石圈和软流圈的斜坡相交的地方很容易发生。因此,从软流圈中出来的CO₂(或CH₄)气体,可以通过在岩石圈的底部进行还原或(氧化)而在矿物粒子间沉积,最终形成金刚石。因此在岩石圈–软流圈交界面与金刚石–石墨相转变面所限定的透镜状区域内可能会形成金刚石。而且,不同深度下的金刚石,其形状也是不同的。研究显示,岩浆温度、岩浆在岩壳中滞留的时间、氧气逸度等是影响金刚石稳定性的重要因素。在这些因素中,氧气逸散对环境的影响最为显著。当氧气浓度越大、温度越高、金刚石迁移时间延长时,金刚石容易被氧化,难以保存。
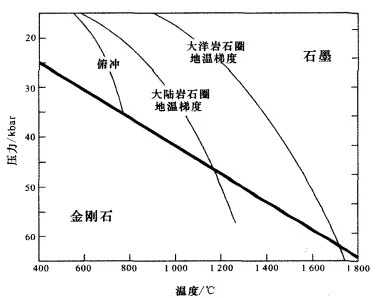 金刚石形成和保存的温压条件
金刚石形成和保存的温压条件
分布情况
金刚石矿床分布在A型(>25亿年)克拉通和P型(16亿~25亿年)克拉通上。目前世界上主要的金刚石矿山集中分布在南非、西伯利亚、北美、西非、中非和澳大利亚6个A型克拉通上。目前世界上有48个国家发现了金刚石。
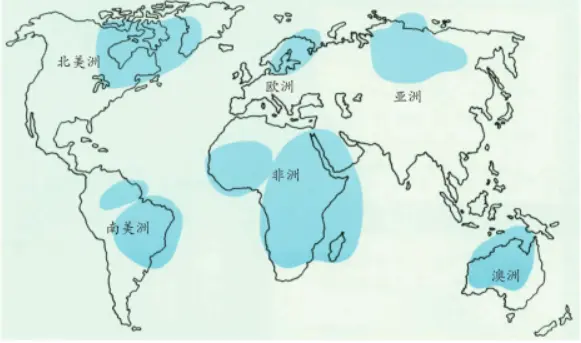 世界上主要的金刚石矿山分布示意图
世界上主要的金刚石矿山分布示意图
物质结构
编辑金刚石结构分为等轴晶系四面六面体立方体与六方晶系。除面心立方晶胞所含有的原子外,其内体对角线上还存在4个原子。每个金刚石结构的惯用原胞共含8个原子。这种结构类似于原来互相重叠的两个面心立方子晶格沿体对角线相互平移错开体对角线长度的1/4套构而成。尽管它是由全同的碳原子组成,但顶点和面心上的原子与惯用原胞内的原子间的取向不同,因此金刚石结构不是布拉菲格子而是复式格子。金刚石结构的布拉菲格子是面心立方,初基原胞为平行六面体,基元包含2个全同的原子,分别位于(0.0,0)和(1/4,1/4,1/4)处。下图展示了金刚石结构的惯用原胞,
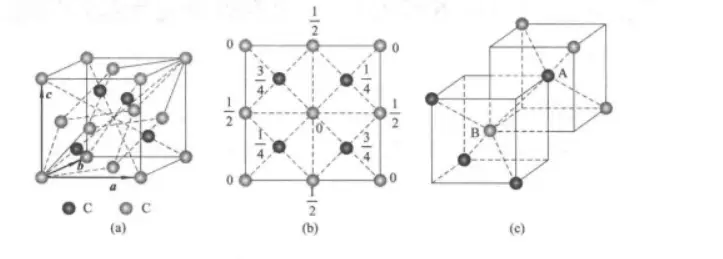 金刚石晶体结构当碳原子构成金刚石时,碳原子2s和3个2p轨道经过sp杂化之后将形成四个等性的sp³杂化轨道,每个sp³杂化轨道都具有1/4的s成分和3/4的p成分,因此它们的形状相同。它们的对称轴相交成一定的角度并指向四面体的4个顶角。每个碳原子用这种杂化轨道与相邻的4个碳原子形成4个“头碰头”的σ共价键,碳碳单键方向性和饱和性。晶体中没有自由电子,所有价电子都参与成键,而处于金刚石表面的碳原子存在一悬挂键。sp³杂化轨道所形成的正四面体结构,可以存在于立方晶系中,也可存在于最密六方晶系。因此,金刚石便具有两种不同的晶体结构–六方金刚石和立方金刚石。金刚石是单质碳,与石墨、黑金刚石、富勒烯矿等矿物为同质多象体,属于等轴晶系。由于在形成过程中常常受外界环境的影响而使晶面、晶棱受到熔蚀(或溶蚀)而呈弯曲不平。熔蚀与其形成过程中的氧逸度有关,低氧逸度往往导致更多的熔蚀坑。晶形常呈浑圆状,在晶体表面,常出现三角形、四边形、网状、锥形等凹陷(这就是蚀象)。
金刚石晶体结构当碳原子构成金刚石时,碳原子2s和3个2p轨道经过sp杂化之后将形成四个等性的sp³杂化轨道,每个sp³杂化轨道都具有1/4的s成分和3/4的p成分,因此它们的形状相同。它们的对称轴相交成一定的角度并指向四面体的4个顶角。每个碳原子用这种杂化轨道与相邻的4个碳原子形成4个“头碰头”的σ共价键,碳碳单键方向性和饱和性。晶体中没有自由电子,所有价电子都参与成键,而处于金刚石表面的碳原子存在一悬挂键。sp³杂化轨道所形成的正四面体结构,可以存在于立方晶系中,也可存在于最密六方晶系。因此,金刚石便具有两种不同的晶体结构–六方金刚石和立方金刚石。金刚石是单质碳,与石墨、黑金刚石、富勒烯矿等矿物为同质多象体,属于等轴晶系。由于在形成过程中常常受外界环境的影响而使晶面、晶棱受到熔蚀(或溶蚀)而呈弯曲不平。熔蚀与其形成过程中的氧逸度有关,低氧逸度往往导致更多的熔蚀坑。晶形常呈浑圆状,在晶体表面,常出现三角形、四边形、网状、锥形等凹陷(这就是蚀象)。
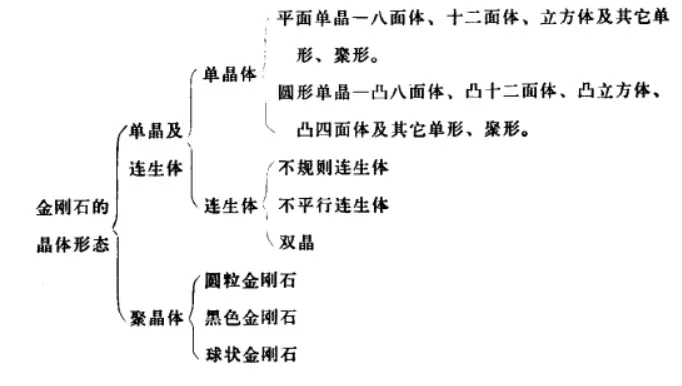 金刚石的晶体形态分类
金刚石的晶体形态分类
理化性质
编辑物理性质
力学性质
硬度和耐磨性金刚石是当今世界上最硬的物质,它具有极好的耐磨和研磨性能,超过了任何一种磨料。它的莫氏硬度达到10,维氏硬度达到98GPa。不同矿床的金刚石在硬度上有差异,同一矿床产出不同颜色的金刚石其硬度也不相同。,包裹体的存在也影响金刚石的硬度。包裹体越多,金刚石的硬度愈小。脆性金刚石的脆性较差,在较小的冲击下,会导致金刚石沿着解理面断裂。含有包裹体和已经破碎的金刚石碎块,耐冲击力更小。比重比重质纯、结晶完好的金刚石比重为3.52。由于金刚石晶体中包裹体的种类和数量不同,金刚石的比重也不尽相同,一般为3.47~3,56。含石墨包裹体多者比重小。
光学性质
颜色颜色纯净的金刚石无色透明,但比较少见。多数金刚石晶体呈不同颜色,最常见的是黄色、浅黄色、绿色、浅绿色、棕色和浅棕色,其次是橙色、黑色等。红色、蓝色的金刚石比较少见。光泽根据金刚石光泽的强弱,可以划分为强、中、弱三种。透光率、折射率金刚石的透光率高,折射率高,对其进行研磨成细小颗粒,能反射出更多的光,使其看起来更加明亮;高色散度也会让金刚石产生“光彩”,其原因是白光被金刚石具体分散为单色光。金刚石的色散值是天然宝石中最大的。理论分析表明,纯净的金刚石应该是无色的。它能穿透包括红外线和紫外线在内的多种波长的光线。这是由于在将金刚石晶体中的电子从基态激发到第一激发态,这比可见光的能量(1.77-3.10电子伏特)要高得多。透明度透明度是衡量金刚石质量的重要指标之一。纯净金刚石透明如水,随着金刚石晶体所含微量元素和杂质元素不同,金刚石透明度分为透明、半透明、不透明三种。
电、磁、热性质
电性一般来说,金刚石是电的不良导体。金刚石的电学特性以可掺杂性为主,经适当的掺杂,可以获得具有半导体材料特性的金刚石。与半导体材料硅和锗相比,金刚石的电化学性能及Johnson价质数均高得多。磁性金刚石是一种不具有磁性的矿石。但有些钻石晶体因其包含磁铁矿、钛铁矿等磁性包裹体而产生磁性。导热性在常温条件下,金刚石的导热系数是目前已知的最好的。CVD金刚石的热导率在1000~2000W/m·k之间,比天然金刚石的高,比铜高出6倍,是硬质合金的13~26倍。耐热性金刚石的化学性质很稳定,可以在任何高温下耐受具有非氧化性的酸,但不能抵抗强碱、含氧酸盐和熔融金属。在720~800°C的纯氧条件下发生氧化,在800~1700°C的真空条件下,会形成一层薄的石墨化层,在氮气和氢气的保护作用下,即使1000℃下不发生氧化。
化学性质
化学稳定性
金刚石的化学性能稳定,能够耐各种温度下的非氧化性酸,但是不耐强碱,含氧酸盐以及熔融金属。例如用强氧化剂高氯酸钾(KCIO)、高氯酸钠(NaCIO)在380℃下对金刚石的{111}面侵蚀181h后,该面出现腐蚀现象。在430℃的硝酸钠熔盐中,以及在熔融的金属中会发生溶解。
氧化性
在氧气中600℃时开始氧化,720℃时燃烧,在空气中850℃时燃烧。低真空度如1kPa~1Pa环境中残存的氧气,会使金刚石表面生成一层致密黑色的石墨膜,可用热的高氯酸或王水除去。该石墨膜的形成温度在600℃以上但是并非是金刚石向石墨的固态相变,而是一氧化碳或二氧化碳的转变产物。在洁净的惰性气体中加热到1500℃,金刚石的石墨化反应才会开始,而在2100℃时,石墨化速度加快。用离子束侵蚀技术可达到2000Å/min的侵蚀速度。
表面性质
金刚石是一种非极性矿物,它的表面亲油性较高,润湿接触角为80°~120°。金刚石本身的纯度以及表面的清洁程度都会影响余刚石表面的性能。
制备方法
编辑静态法
静压触媒法是在高温、超高压、金刚石热稳定性的条件下,通过催化剂的作用,制备出金刚石。它是由石墨作为原材料,由过渡金属或合金作为催化剂,由液压机械驱动,产生恒定高压,通过直流或交流的电流,在石墨上形成持久的高温,从而将石墨转变为金刚石。转化条件一般为:压力5~7GPa,温度1300~1700℃。
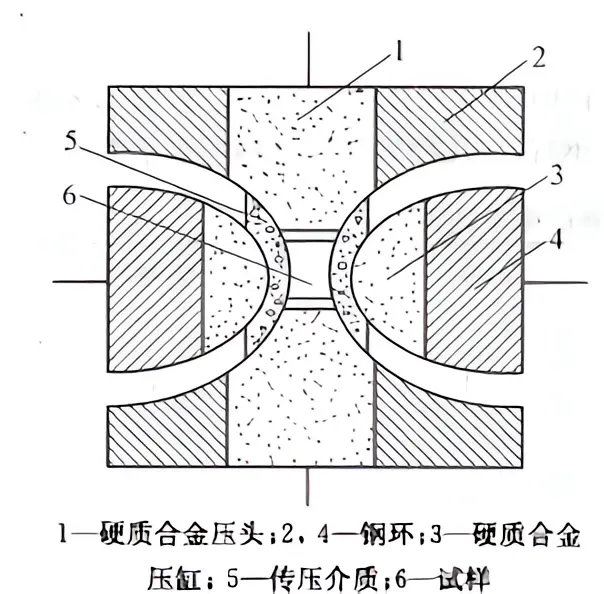
两面顶压机结构示意图
金属催化石墨转化为金刚石反应原理金属催化石墨转化为金刚石反应有两种理论。一种是金属表面作用的理论:金属镍[niè]是一种面心立方晶体。镍原子的二维密置层的法线方法是立方晶胞的对角线方向,在晶体上成为(111)方向,而每个镍原子周围有六个镍原子的二维密置层称为(111)面。镍原子之间会构成正三角形,三角形的边长为249pm。与石墨二维面上的碳原子之间相互连接构成的三角形的边长(246pm)非常相近。当金属镍的表面正好是(111)面而又正好对着二维平面时,镍原子便和碳原子之间一对一地形成了化学键,在石墨的二维平面上,有一半的碳原子被拉到了镍的表面,在高压下,石墨的层间距从335pm被压缩,从而使碳原子的杂化类型由sp²转化为sp³。由于铁、钴、镍这些元素它们结晶形状都是相似的,所以它们使石墨向金刚石转变的催化剂。另外一种理论是,石墨中的碳可以单独的进入到金属原子四面体空隙中,并在金属原子的作用下使其原子轨道杂化成sp³,碳原子与其他原子的扩散接触而形成金刚石。
动压法
动压法以爆炸法为主。采用黑索金、三硝基甲苯等强力炸药,在极短的时间内,爆炸产生强冲击波对石墨进行了强烈的冲击,就能形成60-200GPa的高电压和几千度的高温,将石墨转化成金刚石。一种常见的爆炸法装置是单飞片装置。
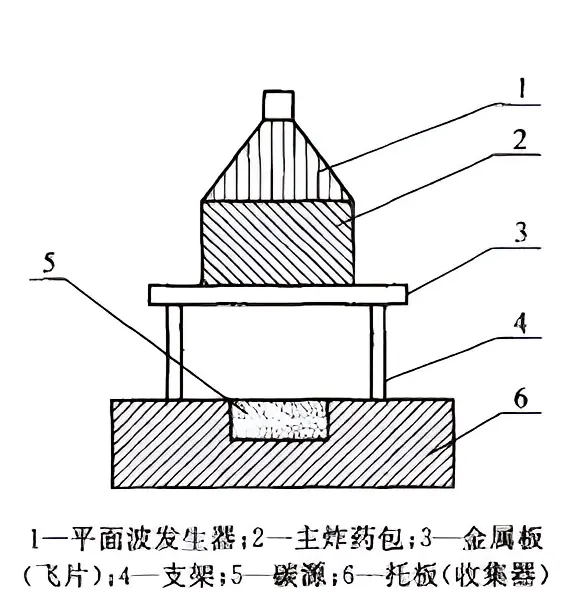
单飞片爆炸合成装置示意图
化学气相沉积
化学气相沉积技术是将所需要的气体在较低的温度下解离为碳原子原子、甲基原子团等一些活性粒子,并对其它影响因素进行控制,从而在基质上形成一层金刚石薄膜的一种化学气相沉积法。(1)热丝直流等离子体(HFCVD)制备方法;原理:在靠近基底表面的螺线乌丝上,对钨丝施加电流,从而控制灯丝的温度,然后注入含碳气体和氢气,然后高温加热,将其分解为含有碳的活性基团和氢原子,再进行一系列的化学反应,最终反应达到基体的表面,并在适当的位置形成晶核,最终沉积形成金刚石薄膜。(2)微波(MPCVD)制备方法;
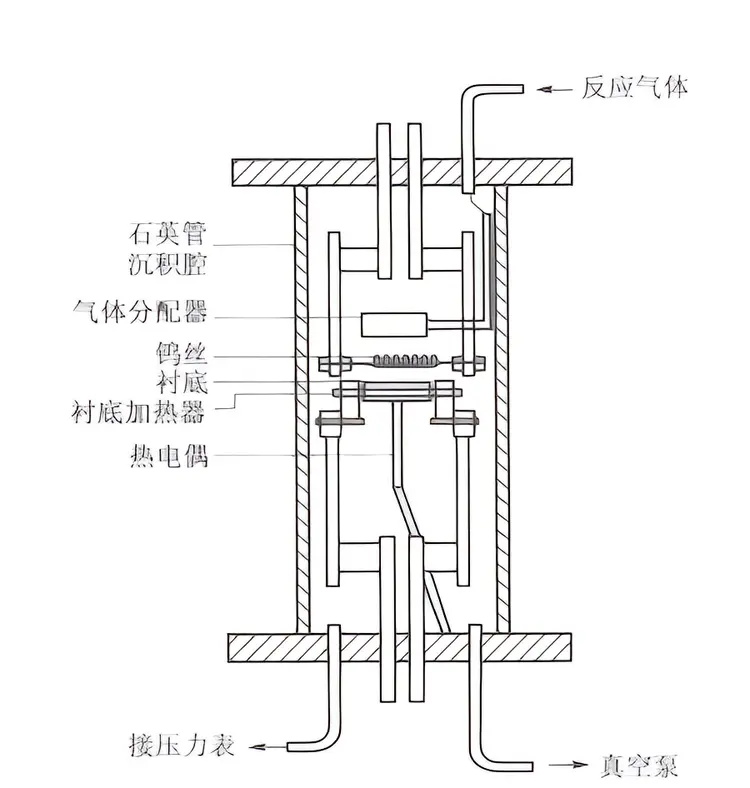
热丝CVD法金刚石沉积设备示意图
原理:微波等离子体与其它等离子体不同,它是通过高频率的微波电场引起电子的强烈振动,并与含碳气、氢气发生碰撞而激发生成反应活性基团和原子,并通过加热衬底来达到在衬底上形成金刚石薄膜的目的。石英管式MPCVD装置是目前化学气相沉积金刚石普遍采用的方法之一。
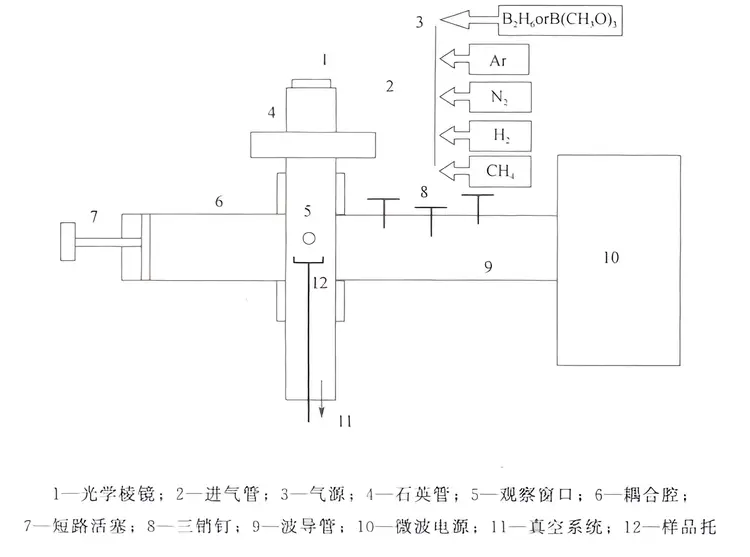
石英管式MPCVD系统原理图
(3)直流电弧等离子体喷射(DCAJ CVD)制备方法;原理:工作气体如Ar、H₂和CH₄等在棒状阴极与水冷铜阳极之间进行直流电弧放电下大面积电离,从而产生高温等离子体,离子体的高能量和一系列复杂的化学反应导致了甲烷的脱氢,其中碳原子在气场和电磁场的双重作用下,以极快的速度喷射到基板上,最终在钼[mù]基板上形成了一层金刚石薄膜。
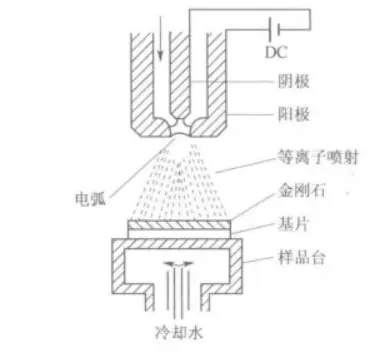 DCPJCVD系统示意图(4)直流热阴极等离子体(DCPACVD)制备方法。在阴极和阳极之间施加直流电压。采用脉冲高压放电,使阴极和阳极之间的气体放电,形成电弧,产生等离子体。在阴极和阳极之间通人的Ar₂、H₂和CH₄的混合气体通过喷嘴处的等离子体区时,被迅速加热到高温,在电离、热解和光辐射三种机制作用下产生高密度的离子、自由基以及中性基团等。它们在压力差的作用下,以接近声速的高速度从喷嘴喷出,形成了等离子体射流。该等离子体射流撞击基底上冷却,沉积为金刚石膜。
DCPJCVD系统示意图(4)直流热阴极等离子体(DCPACVD)制备方法。在阴极和阳极之间施加直流电压。采用脉冲高压放电,使阴极和阳极之间的气体放电,形成电弧,产生等离子体。在阴极和阳极之间通人的Ar₂、H₂和CH₄的混合气体通过喷嘴处的等离子体区时,被迅速加热到高温,在电离、热解和光辐射三种机制作用下产生高密度的离子、自由基以及中性基团等。它们在压力差的作用下,以接近声速的高速度从喷嘴喷出,形成了等离子体射流。该等离子体射流撞击基底上冷却,沉积为金刚石膜。
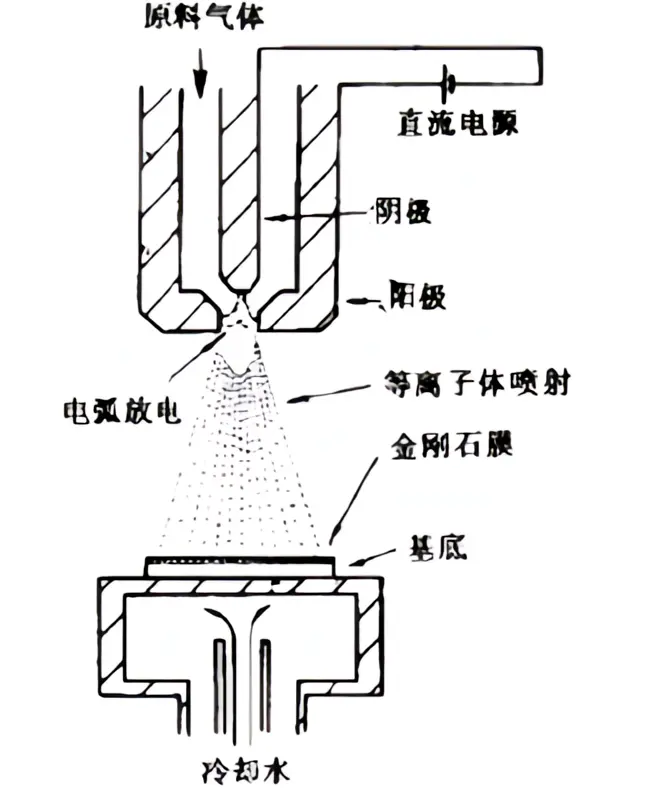
用直流等离子体喷射CVD法装置示意图
应用领域
编辑机械工业领域
作为磨削工具应用人造金刚石可以制成各种砂轮、磨石、砂布、砂纸、研磨膏等多种形式进行磨削应用。金刚石磨具是磨削硬质合金的特效工具。作为切削刀具应用金刚石聚晶复合片或天然大单晶制成车刀、罐刀、铣刀、铰[jiǎo]刀等,用来精加工汽车、飞机、精密机械上的非铁金属零件以及塑料、陶瓷之类的非金属材料,是高速高效高精切削工具中最重要的一类。作为锯切工具应用金刚石锯切工具分为两类,第一类锯切刀具主要有:花岗岩、大理石、人造铸石、混凝土切割用的圆锯、带锯、绳锯等;另一类是用来切削贵金属及半导体材料、精细陶瓷材料的内圆锯片和外圆锯片。作为钻探工具应用钻探工具包括地质、石油、煤炭、冶金等行业中的勘探和开采用的钻头、扩孔器以及建筑工程套钻,在这些领域中,金刚石钻头应用十分广泛。
光学应用领域
在各种固态薄膜中,金刚石具有最大的透射光谱带,可见光和红外光在金刚石中具有很好的穿透能力,且金刚石具有很好的抗辐射能力,可以应用于激光窗口或其它透镜材料,也可以作为一种光学防护涂料。
电子学应用领域
金刚石薄膜由于具有载流子饱和速率大、击穿电压高、升电常数低、热导率高等优异性能,被认为是大功率、高频及恶劣环境下使用的电子元件的理想材料。它有可能制备微波甚至于毫米波段超高速计算机芯片,高电压高速开关及固体功率放大器。
珠宝领域
宝石级金刚石主要用于做钻戒、项链、耳环、胸花、王冠、权杖等用品,以及原石收藏等方面。据统计,在全世界每年的珠宝贸易总额中,钻石交易额约占80%。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/1232891/
