什么是肌红蛋白
编辑肌红蛋白(符号Mb或MB)是一种铁和氧结合蛋白,存在于一般脊椎动物和几乎所有哺乳动物的骨骼肌组织中。肌红蛋白与血红蛋白有远亲关系。与血红蛋白相比,肌红蛋白对氧的亲和力更高,并且不像血红蛋白那样与氧协同结合。但本质上,它是红细胞中的一种氧结合蛋白.在人类中,肌红蛋白仅在肌肉受伤后才在血液中发现。
肌肉细胞中高浓度的肌红蛋白使生物体能够长时间屏住呼吸。鲸鱼和海豹等潜水哺乳动物的肌肉中肌红蛋白含量特别高。肌红蛋白存在于I型肌肉、IIA型和IIB型肌肉中,但大多数文本认为肌红蛋白不存在于平滑肌中。
肌红蛋白是第一个通过X射线晶体学揭示其三维结构的蛋白质。1958年,JohnKendrew及其同事报告了这一成就。为了这个发现,肯德鲁共享1962年诺贝尔化学奖与最大佩鲁茨。尽管是生物学中研究最多的蛋白质之一,但其生理功能尚未最终确定:基因工程缺乏肌红蛋白的小鼠可以存活和繁殖,但显示出许多细胞和生理适应来克服这种损失。通过观察肌红蛋白耗竭小鼠的这些变化,假设肌红蛋白功能与增加向肌肉的氧气运输和氧气储存有关。此外,它还可作为活性氧的清除剂。
在人类中,肌红蛋白由MB基因编码。
肌红蛋白可以采用氧合肌红蛋白(MbO2)、碳氧肌红蛋白(MbCO)和高铁肌红蛋白(met-Mb)的形式,类似于血红蛋白采用氧合血红蛋白(HbO2)、碳氧血红蛋白(HbCO)和高铁血红蛋白(met-Hb)的形式。
与血红蛋白的区别
编辑与血红蛋白一样,肌红蛋白是一种细胞质蛋白,可与血红素基团上的氧结合。它只有一个球蛋白组,而血红蛋白有四个。尽管其血红素基团与Hb中的血红素基团相同,但Mb对氧的亲和力高于血红蛋白。这种差异与其不同的作用有关:血红蛋白运输氧气,而肌红蛋白的功能是储存氧气。
在美食中的作用
编辑肌红蛋白含有血红素,这是导致红肉颜色的色素。肉的颜色部分取决于肌红蛋白的氧化程度。在新鲜肉类中,铁原子处于与氧分子(O2)结合的亚铁(+2)氧化态。肉熟做得好是棕色因为铁原子现在处于三价铁(3)氧化态,失去一个电子。如果肉暴露在亚硝酸盐中,它会保持粉红色,因为铁原子与NO、一氧化氮结合(例如咸牛肉或腌制火腿也是如此))。烤肉也可以呈现出红粉红色的“烟圈”,它来自与一氧化碳结合的血红素中心。由于相同的原理,在一氧化碳气氛中包装的生肉也显示出同样的粉红色“烟圈”。值得注意的是,这种生肉的表面也呈现出粉红色,这在消费者的印象中通常与新鲜肉有关。这种人工诱导的粉红色可以持续存在,据报道长达一年。据报道,荷美尔和嘉吉(美国的肉类加工公司)都使用这种肉类包装工艺,这种处理方式的肉类自2003年以来一直在消费市场上销售。
在疾病中的作用
编辑肌红蛋白从受损的肌肉组织(横纹肌溶解症)中释放出来,肌红蛋白的浓度非常高。释放的肌红蛋白被肾脏过滤,但对肾小管上皮有毒,因此可能导致急性肾损伤。有毒的不是肌红蛋白本身(它是一种原毒素),而是在酸性环境(例如酸性尿液、溶酶体)中与肌红蛋白分离的铁血酸部分。
肌红蛋白是肌肉损伤的敏感标志物,使其成为胸痛患者心脏病发作的潜在标志物。然而,升高的肌红蛋白对急性心肌梗死(AMI)的特异性较低,因此应考虑CK-MB、心肌肌钙蛋白、ECG和临床体征来进行诊断。
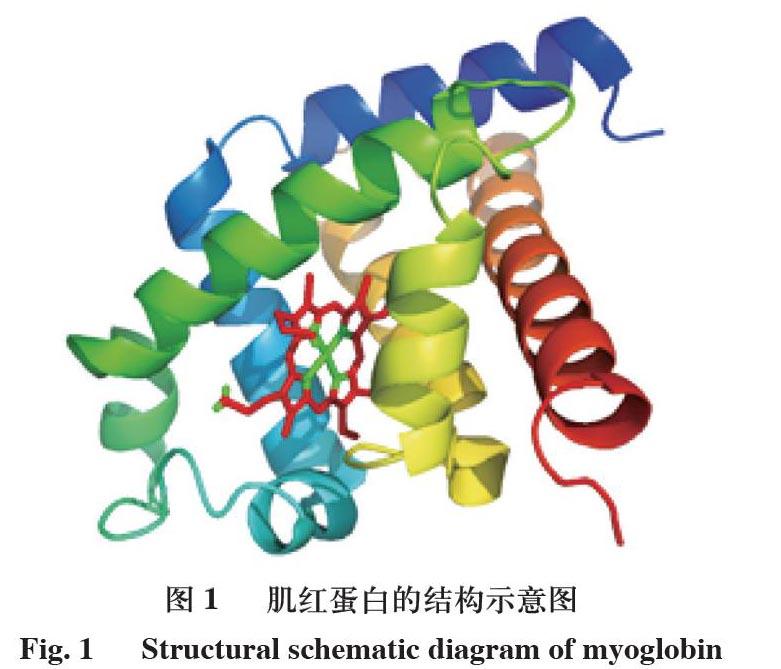
结构和键合
编辑肌红蛋白属于蛋白质的珠蛋白超家族,与其他珠蛋白一样,由8个通过环连接的α螺旋组成。肌红蛋白含有153个氨基酸。
肌红蛋白包含一个以铁为中心的卟啉环。甲近端组氨酸基团(HIS-93)直接附连到铁,和一个远端的组氨酸基团(HIS-64)的相对面附近徘徊。远端咪唑不与铁键合,但可与底物O2相互作用。这种相互作用会促进O2的结合,但不会促进一氧化碳(CO)的结合,CO的结合力仍比O2强约240倍。
O2的结合导致Fe中心发生显着的结构变化,其半径缩小并移动到N4口袋的中心。O2结合诱导“自旋配对”:五配位亚铁脱氧形式是高自旋,六配位氧形式是低自旋和抗磁性。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/124485/
