肽键
编辑在有机化学中,肽键是一种酰胺类型的共价化学键,连接两个连续的α-氨基酸,一个α-氨基酸的 C1(第一个碳)和另一个α-氨基酸的 N2(第二个氮)沿着肽或蛋白质 链。
它也可以称为肽键,以区别于异肽键,异肽键是两个氨基酸之间的另一种酰胺键。
综合
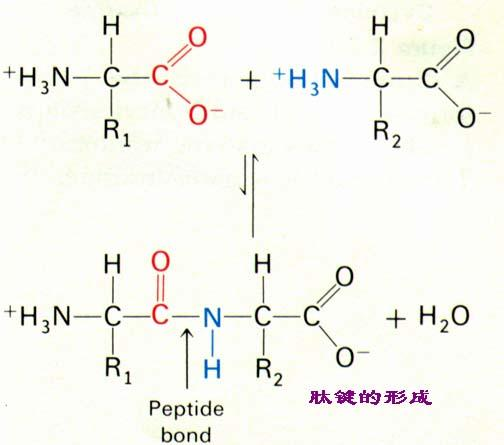
编辑当两个氨基酸通过肽键形成二肽时,这是一种缩合反应。 在这种缩合中,两个氨基酸相互靠近,其中一个的非侧链 (C1) 羧酸部分靠近另一个的非侧链 (N2) 氨基部分。 一个从其羧基 (COOH) 中失去一个氢和氧,另一个从其氨基 (NH2) 中失去一个氢。 该反应产生一个水分子 (H2O) 和两个通过肽键 (−CO−NH−) 连接的氨基酸。 两个连接的氨基酸称为二肽。
当一个氨基酸分子的羧基与另一个氨基酸分子的氨基反应时,会合成酰胺键,导致释放出一分子水(H2O),因此该过程是脱水合成反应。
肽键的形成消耗能量,在生物体中,能量来自 ATP。 肽和蛋白质是通过肽键(有时通过一些异肽键)连接在一起的氨基酸链。 生物体使用酶产生非核糖体肽,并使用核糖体通过与脱水合成在细节上不同的反应产生蛋白质。
一些肽,如 alpha-amanitin,被称为核糖体肽,因为它们是由核糖体制成的,但许多肽是非核糖体肽,因为它们是由专门的酶而不是核糖体合成的。 例如,三肽谷胱甘肽是通过两种酶从游离氨基酸分两步合成的:谷氨酸–半胱氨酸连接酶(形成异肽键,不是肽键)和谷胱甘肽合成酶(形成肽键)。
退化
编辑肽键可以通过水解(加水)而断裂。 肽键在水中的水解释放出 8–16 kJ/mol (2–4 kcal/mol) 的吉布斯能。 这个过程非常缓慢,在 25°C 下每个键的半衰期在 350 到 600 年之间。
在活生物体中,该过程通常由称为肽酶或蛋白酶的酶催化,尽管有报道称肽/蛋白质折叠成天然结构时由构象应变引起肽键水解。 因此,这种非酶促过程不会因过渡态稳定而加速,而是因基态不稳定而加速。
光谱
编辑肽键的吸收波长为 190–230 nm,这使其特别容易受到紫外线辐射的影响。
肽组的顺/反异构体
编辑氮原子上孤电子对的显着离域使该基团具有部分双键特征。 部分双键使酰胺基团呈平面状,出现在顺式或反式异构体中。 在蛋白质的展开状态下,肽基团可以自由异构化并采用两种异构体; 然而,在折叠状态下,每个位置仅采用一个异构体(极少数例外)。 在大多数肽键中,反式形式是压倒性的首选(反式:顺式群体中的比率大约为 1000:1)。 然而,X-Pro 肽组往往具有大约 30:1 的比例,大概是因为脯氨酸的 Cα 和 Cδ 原子之间的对称性使得顺式和反式异构体的能量几乎相等。
与肽组相关的二面角(由四个原子 Cα–C’–N–Cα 定义)表示为 ω {dISPlaystyle omega } ; ω = 0 ∘ {diSPlaystyle omega =0{circ }} 对于顺式异构体(同平面构象),以及 ω = 180 ∘ {displaystyle omega =180{circ }} 反式异构体(反周面构象)。
酰胺基团可以异构化顺式和反式之间的 C’-N 键,尽管速度很慢(室温下 τ ∼ 20 {displaystyle tau sim 20} 秒)。 过渡态 ω = ± 90 ∘ {displaystyle omega =pm 90{circ }} 要求部分双键断裂,因此活化能大约为 80 kJ/mol(20 kcal/ 摩尔)。 然而,通过有利于单键形式的变化可以降低活化能(并催化异构化),例如将肽基团置于疏水环境中或为 X-Pro 肽基团的氮原子提供氢键 . 这两种降低活化能的机制都已在肽基脯氨酰异构酶 (PPIases) 中观察到,PPIases 是天然存在的酶,可催化 X-Pro 肽键的顺反异构化。
构象蛋白质折叠通常比顺反异构化(10-100 秒)快得多(通常为 10-100 毫秒)。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/214750/
