缬氨酸
编辑缬氨酸,缩写为 Val 或 V,其天然 L 型是一种必需的蛋白源性 α-氨基酸,在所有主要蛋白质中都有少量存在。 在结构上,缬氨酸是通过用氨基 (–NH2) 取代 α-氢原子而衍生自异戊酸。
在酒精发酵中,缬氨酸被酵母酶发酵成异丁醇,异丁醇是杂醇油的一种成分(氨基酸发酵)。 晚收葡萄的氨基酸含量明显较高,包括缬氨酸含量。
摩尔质量:117.15 g mol
密度
- 1.23 g cm (L-缬氨酸)
- 1.31 g cm (DL-缬氨酸)
- 315 °C (L-缬氨酸)
- 302-303 °C (D-缬氨酸)
- 283.5-285 °C (DL-缬氨酸)
pKa值
- pKa, COOH = 2.29
- pKa, NH3 = 9.72
异构体
编辑缬氨酸有一个立体中心,所以有两个对映体。 如果在本文和科学文献中提到“缬氨酸”而没有任何添加,则始终指的是天然存在的 L-缬氨酸。 在这篇文章中,关于生理学的信息也只适用于L-缬氨酸。
Racemic 缬氨酸作为化学工业的中间产品具有重要的经济意义。 对映体纯的D-缬氨酸主要由DL-缬氨酸生产,在环孢菌素的生产中具有实际意义。 L-氨基酸的外消旋作用可用于氨基酸定年——确定骨骼化石的年龄。
出现次数
编辑由于人体不能产生缬氨酸,因此必须通过食物来供应。 以下例子中蛋白质结合蛋白含量均以100g食品为基准,并给出了占总蛋白的百分比。
所有这些食物几乎都含有化学结合的 L-缬氨酸作为蛋白质成分,但不含游离的 L-缬氨酸。
根据所使用的方法,估计健康成人的每日需要量为每公斤体重 10 至 29 毫克。
生化重要性
编辑缬氨酸是蛋白质生物合成的组成部分,但也可用于在富含蛋白质的食物或动员人体自身蛋白质储备的情况下产生能量。 例如,缬氨酸与其他两种具有支链碳链的氨基酸亮氨酸和异亮氨酸一样,起到滋养肌肉的作用。 这在长时间的劳累或饥饿期间发挥作用,此时身体必须依靠自己的储备。缬氨酸的分解产生丙酰辅酶 A,丙酰辅酶 A 在转化为琥珀酰辅酶 A 后,有助于柠檬酸循环的填充。
表示与采集
编辑缬氨酸的表示可以通过Strecker综合来完成。 起始产物是异丁醛(异丁醛):
在 Strecker 合成中,形成了 DL-缬氨酸。 对于外消旋拆分,DL-缬氨酸在氮原子上被乙酰化。 由此形成的 DL-N-乙酰缬氨酸进行酶促外消旋拆分。 L-乙酰化酶对映选择性地将 L-N-乙酰缬氨酸中的酰胺键水解为乙酸和 L-乙酰缬氨酸,而 D-N-乙酰缬氨酸保持不变。
L-缬氨酸也可以通过生物技术工艺发酵直接获得。 起始材料取决于所使用的细菌培养物。 例如,乳发酵芽孢杆菌需要葡萄糖,黄唐松草需要乙酸,而嗜乙酰角膜杆菌需要乙醇作为骨骼碳的来源。为了增加产量并防止形成不需要的产品,这些通常是专门培育(基因改造或选择)的培养物。
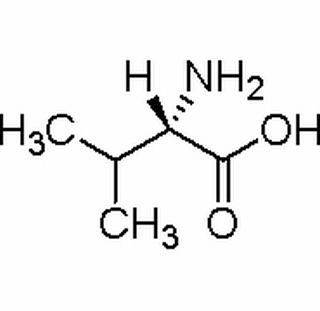
属性
编辑缬氨酸具有亲脂性侧链。 辛醇-水分配系数为 −2.26 (log KOW)。 等电点为5.96,范德瓦尔斯体积为105。缬氨酸主要以“内盐”或两性离子的形式存在,其形成可以通过羧基的质子连接到氨基氮原子的孤单电子对迁移。
两性离子不会在电场中迁移,因为它作为一个整体是不带电的。 严格来说,在等电点(在一定的 pH 值)是这样的,在这个点上缬氨酸在水中的溶解度也是最低的。
使用
编辑缬氨酸作为前体(产品分子的完整组成部分)可以提高青霉素形成培养物的产量。
它是能量饮料和肠外营养输液的组成部分。
(S)-缬氨酸在化学中作为一种用于有针对性地生产对映体纯物质的起始材料具有实际意义。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/363583/
