氮气(Nitrogen)是氮元素形成的一种单质,化学式N₂。氮气是空气的主要组成成分,体积分数约为78%(约4/5),比空气稍轻,密度为1.25 g/L。常温常压下,1体积水大约只溶解0.02体积氮气。氮气摩尔质量为28.01 g/mol;结构式为N≡N,键长109.8 pm,键能较大,为948.9 kJ/mol,结构稳定。常温常压下无色无味无毒,在-195.8℃时液化为液氮,-209.9℃时可变为雪状固态。氮气化学性质稳定,能与特别活泼的金属直接化合。氮气可用于灭火,液氮常用作冷冻剂。氮气在医药、食品加工、电器保护等领域常作保护气,还是工业合成氨、化肥等的重要原料。
发现历史
编辑1755年,英国化学家约瑟夫·布拉克(Joseph Black)通过煅烧石灰石发现了CO₂,认为这种气体是固定在石灰石中,因此将其命名为“固定空气”。他又发现“固定空气”能被苛性碱溶液吸收,使其变为性质温和的苏打;燃烧的蜡烛在“固定空气”中不能继续燃烧;麻雀和小鼠在“固定空气”中会室息死亡;木炭在玻璃罩内燃烧后的气体有一部分和“固定空气”相似,能被苛性碱溶液吸收,但继续加入苛性钾,总有气体剩余。1772年,英国化学家丹尼尔·卢瑟福(Daniel Rutherferford)研究发现“固定空气”既不助燃,不能溶于苛性碱,也不能维持呼吸,便将其命名为“浊气”。1772年英国化学家约瑟夫·普利斯特利(Joseph Priestley)把潮湿的硫磺粉放在密闭容器中,一段时间后,容器中的空气减少了1/5,经过研究发现,剩余气体与卢瑟福发现的“浊气”性质相似,且比空气轻。因普里斯特利相信燃素说,将这种剩余气体命名为“燃素化了的空气”或“被燃素饱和了的空气”。同年,瑞典化学家卡尔·威尔海姆·舍勒(Carl Wilhelm Scheele)通过实验获得类似结果,并命名为“劣质空气”。1774年法国化学家安托万·洛朗·拉瓦锡(Antoine-Laurent de Lavoisier)将“劣质空气”命名为“Nitrogen”,意为“无益于生命”,即“氮”。
分布情况
编辑氮气广泛分布在自然界中。在空气中所占体积分数约为78%。动植物体中的蛋白质都含氮。氮在土壤中以硝酸盐的形式存在,如南美洲的智利硝酸盐矿藏,在地壳中的分度为19ppm。氮具有¹⁴N和¹⁵N两种天然同位素。氮气常常是一些低级生物像植物根瘤菌上的固氮细菌等的肥料,它们将空气中的氮气固定,转化为含氮化合物。
N₂分子的结构
编辑路易斯结构式
N原子的核外电子排布式为1s²2s²2p³,两个氮原子以氮氮三键结合。1个N原子与另一个N原子的两个2p轨道以“肩并肩”的形式形成π键,围绕在σ键的四周,所以N≡N键能大,为948.9 kJ/mol,不易断裂,N₂分子结构稳定。N≡N键长为109.8 pm,是由1个σ键和2个π键形成的,其中1个2p轨道与另一个N原子的2p轨道以“头碰头”的形式形成σ键,处于中间位置。
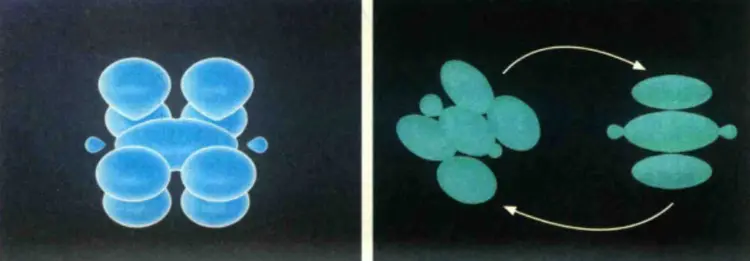
图2 N₂分子的形成过程及N₂的π键

图3 N₂的电子式

图4 N₂的路易斯结构式
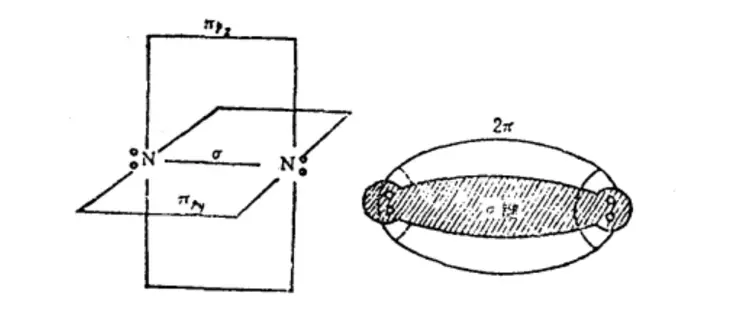
图5 N₂的结构示意图
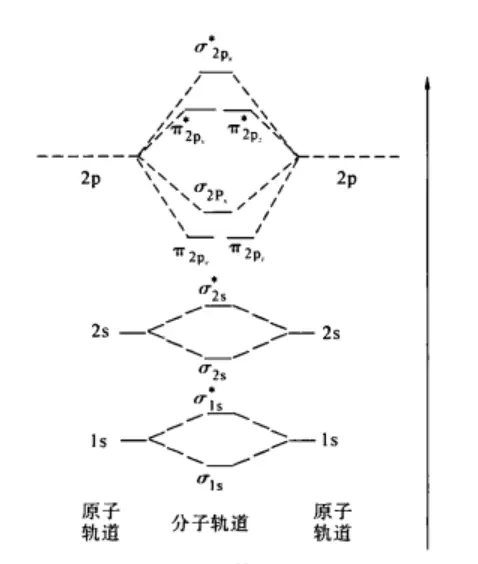
分子轨道排布式
N₂分子有10个电子进入分子轨道,其中8个成键电子和2个反键电子,键级为3,稳定性非常高。N₂的分子轨道电子排布式为
,表明该分子间存在1个σ键和2个π键,与路易斯结构式相一致。
等电子体
等电子体是电子数和原子数均相等的分子、离子。互为等电子体的分子或离子在某些方面具有相似性质。N₂是2原子10电子的直线型分子,与NO⁺、CN、CO、C₂²⁻互为等电子体。
理化性质
编辑物理性质
氮气与空气密度接近,比空气稍轻,密度为1.251 g/L(0 ℃,1 atm),摩尔质量为28.01 g/mol,微溶于水和乙醇,常温常压下,1体积水大约只溶解0.02体积氮气。在正常情况下,氮气对人体并无伤害,但在高压条件下,大量氮气会溶于血液导致氮醉。氮气是热和电的不良导体。标准大气压下,冷却至-195.8 ℃时氮气液化为液氮,-209.9 ℃时凝固成雪状固态。液氮与氮气相比,具有体积小(0 ℃时两者体积比为1/647,35℃时为1/731)、易储存、运输量小等优点。
化学性质
氮气是一种双原子气体,结构稳定,化学性质稳定。氮气是一种惰性气体,不可燃,不助燃,不供人呼吸,无腐蚀性。在自然条件下,不发生化学反应。在一定条件下能与部分活泼金属和非金属单质化合。
与金属单质反应
氮可与一些特别活泼的金属反应,形成离子型氮化物。常温下能与锂直接化合生成氮化锂(Li₃N):
高温时能与镁、钙、钡[bèi]、锶[sī]直接化合生成相应的氮化物:
镁在空气中主要生成氮化镁,同时伴有少量的氧化镁(MgO)生成。这些离子型氮化物又能与水反应生成氢氧化物和NH₃:
与非金属单质反应
氮气与氢气在高温、高压、催化剂条件下生成氨(工业制氨,人工固氮):
在放电条件或电弧作用下,氮气与氧气反应生成一氧化氮(NO)(自然固氮):
与化合物反应
在胺氰[qíng]法中,氮气和热电石反应,生成氰氨化钙和碳:
然后热氨腈受到压力与水蒸汽发生反应,生成氨:
氮气的制备
编辑实验室制备
①在实验室,通过在溶液中加热亚硝酸钠(NaNO₂)和氯化铵(NH₄CI)的混合物来获得氮气。反应为:
②加热亚硝酸铵溶液:
③将氨通过红热的氧化铜:
④氨与溴水反应:
⑤重铬酸铵加热分解:
工业制备
深冷空分
深空冷分制氮的原理是通过压缩、膨胀循环降低大气温度并使其成为液态,而后利用大气中组分沸点不同分离出氮氧。此方法最大的特点是能同时制取氧和氮并且产量大。
变压吸附
变压吸附法制氮气的原理是利用分子筛对空气加压吸附排氮、减压脱附排氧,从而将氮、氧分离。变压吸附制氮常采用的技术有碳分子筛(CMS)和沸石分子筛(MS)。碳分子筛是一种非极性速度分开型吸附剂,氧气在碳分子筛上的扩散速度大于氮气的扩散速度,因而氧气能够被碳分子筛优先吸附,氮气则富集于不吸附相在吸附塔流出。沸石分子筛制氮则是利用沸石分子筛对O₂、N₂吸附容量不同来分离N₂,不过其处理原料气和真空解吸等步骤繁杂,应用较少。
膜分离
膜分离制氮技术的原理是,氧和氮在通过膜时,会先在膜中溶解,在外界能量或化学位能差的作用下,由于氧、氮对分离膜的渗透率不同,会分别在膜的两侧得到富集,达到分离气体的目的。
应用领域
编辑灭火领域
氮气具有高稳定性和化学惰性,因此可用于灭火。氮气防灭火技术的优点:(1)工艺简单、操作方便、易于掌握;(2)无污染,对设备损害小,恢复生产快;(3)稀释抑爆;(4)有效抑制防灭火区域的漏风。氮气防灭火技术的缺点:(1)不能“长期”覆盖可燃物或已燃物的表面;(2)不能有效消除高温点,需用水、注浆以及凝胶等措施辅助灭火,防止复燃;(3)注氮气防火时,需要采取堵漏措施,控制氮气泄漏量在最低限度内;(4)较高浓度氮气易使人窒息。
氮气吸附法
氮气吸附法能够测量多孔材料的比表面积及孔径分布,该方法需要在液氮温度下进行。吸附法的原理是让一种吸附质分子吸附在待测样品表面,根据吸附量的多少来评测样品的表面积及孔径分布。
保护气
氮气是惰性气体,常做保护气。它可以在药品注射剂生产过程中防氧化;可用作局部用药气雾剂的抛射剂;还可用以置换易氧化溶液中的空气;还可用于置换终包装内产品上方的空气,例如盛装于玻璃安瓿[bù]中的注射剂产品。在电器方面,氮气主要充当电缆、变压器的保护气体以及标准电容器的介质,防止绝缘油氧化、潮气侵入,抑制热老化。氮气会在与钨结合形成氮化钨时释放过高的热量,从而加速钨阴极的损坏。在金属热处理方面,氮气可用于退火、光亮萍火、渗碳、碳氮共渗、粉末金属烧结、中性气体保护气氛。在电子工业方面,氮气气氛保护半导体元器件及集成电路、二极管、三极管的烧结生产。在石油化工方面,各类储罐、催化塔、管道等的充氮净化和压力检漏,石油化工催化剂的生产保护气氛。在化纤工业方面,化学行业原料干燥系统载气、光电纤维的生产过程保护。为将粮食长期保存,可在粮仓中充入氮气,防止粮食发霉发芽。
食品加工
氮气可用于啤酒生产、食品包装、液氮冷冻与保质粉碎、食用油小包装灌装等。在啤酒生产上,氮气可作二氧化碳的替代品,改善啤酒的泡沫性能,防止氧化。在食品包装上,利用氮气排除氧气,抑制食品的氧化和呼吸。在液氮冷冻与保质粉碎上,物料尤其是香料在制作过程中会出现打滑和发热现象,低温冷冻状态时物料变脆,打滑现象消失,碾磨更加顺利。在食用油脂包装灌装过程中使用氮气可以降低氧浓度,延缓油脂的氧化酸败,提高稳定性,达到长期保存的目的。
工业合成原料
氮气可作为电催化合成氨的原料。其原理是在电场作用下,通过类似水中还原H⁺成H₂的一个半反应,电子活化催化剂表面吸附的氮气,而后活化的氮进一步与水供质子发生加氢反应,从而在温和条件下和成氨。在不同的电解质中会发生不同的反应,反应方程式如下。
制冷剂
氮气作为制冷剂,可以类似橡胶物质的凝固磨碎、低温加工橡胶、工程技术部件的冷缩配合和安装、生物标本,如血液的的保存、在运输中制冷等。液氮还可应用于医疗领域,如在除斑、除包、除痘、皮肤治疗等手术时,将病体冻掉,但是容易出现疤痕。
丁二烯生产
乙烯基乙炔是丁二烯装置中最危险的原料,超过一定浓度会发生分解爆炸。使用氮气稀释可吸收乙烯基乙炔分解后的反应热,有效降低分解后的温度和压力。
其他
氮气在汽车上的作用:保持稳定胎压,提高轮胎行驶的稳定性,保证驾驶的舒适性;有效减少轮胎的噪音,提高行驶的宁静度;可以防止爆胎和缺气碾行;延长轮胎使用寿命;减少油耗,保护环境。在外延、光刻、清洗和蒸发等工序中,高纯度氮气可作为置换、干燥、贮存和输送用气体。另外,氮气还可作分析仪器的载气,如标准气、校正气、平衡气及在线仪表标准气等。
安全事宜
编辑危险特性
1.氮气储罐受热后瓶内压力增大,有爆炸危险。2.吸入可迅速出现窒息昏迷、呼吸心跳停止,从而导致死亡。
储存方法
储存于阴凉(<30℃)、通风的库房或密封金属瓶中,贮藏在阴凉、干燥处。远离火种、热源。
泄漏处理方法
1.迅速将人员撤离泄露污染区的上风处,并进行隔离,严格限制出入。2.做好个人防护,尽可能切断泄漏源。3.合理通风,加速扩散。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587253/
