离子键
编辑离子键是一种化学键,涉及带相反电荷的离子之间或两个具有明显不同电负性的原子之间的静电吸引力,是离子化合物中发生的主要相互作用。它是与共价键和金属键一起的主要键合类型之一。离子是带有静电荷的原子(或原子团)。获得电子的原子会产生带负电的离子(称为阴离子)。失去电子的原子会产生带正电的离子(称为阳离子)。与共价相反,这种电子转移称为电价。在最简单的情况下,阳离子是金属原子,阴离子是非金属原子,但这些离子可以具有更复杂的性质,例如分子离子,如NH+4或SO2-4。用更简单的话来说,重要的是要认识到干净的离子键——其中一个原子或分子将一个电子完全转移到另一个原子或分子——不可能存在:所有离子化合物都具有某种程度的共价键或电子共享。因此,当离子特征大于共价特征时,给出了术语离子键-即两个原子之间存在较大电负性差异的键,导致键比共价键更具极性(离子)其中电子被更平等地共享。具有部分离子和部分共价特征的键称为极性共价键。离子化合物在熔融或溶液中导电,通常在固体时不导电。离子化合物通常具有高熔点,具体取决于它们所含离子的电荷。电荷越高,内聚力越强,熔点越高。它们也倾向于溶于水;内聚力越强,溶解度越低。
概述
编辑具有几乎满或几乎空的价壳的原子往往具有很强的反应性。具有强电负性的原子(如卤素)通常在其价壳中只有一个或两个空轨道,并且经常与其他分子键合或获得电子以形成阴离子。弱电负性原子(如碱金属)的价电子相对较少,很容易与强电负性原子共享。结果,弱电负性原子倾向于扭曲它们的电子云并形成阳离子。
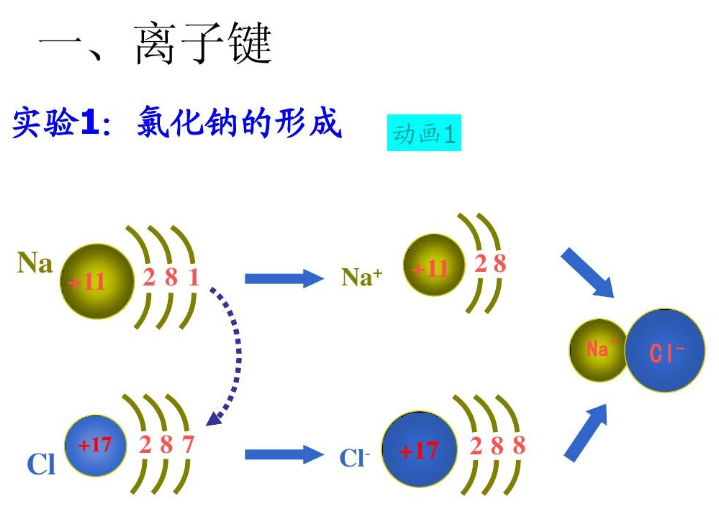
离子键的形成
编辑当电离能低的元素(通常是金属)的原子提供一些电子以实现稳定的电子构型时,离子键可以由氧化还原反应产生。在此过程中,形成了阳离子。具有更大电子亲和力的另一种元素(通常是非金属)的原子接受一个或多个电子以获得稳定的电子构型,并且在接受电子后原子变成阴离子。通常,稳定电子构型是s-block和p-block元素的惰性气体之一,特别是d-block和f-block元素的稳定电子构型。阴离子和阳离子之间的静电吸引力导致形成具有晶格的固体,其中离子以交替方式堆叠。在这样的格子里,通常不可能区分离散的分子单元,因此形成的化合物本质上不是分子。然而,离子本身可以是复杂的并形成分子离子,如乙酸根阴离子或铵阳离子。例如,普通食盐是氯化钠。当钠(Na)和氯(Cl)结合时,钠原子各自失去一个电子,形成阳离子(Na+),氯原子各自获得一个电子形成阴离子(Cl-)。然后这些离子以1:1的比例相互吸引形成氯化钠(NaCl)。Na+Cl→Na++Cl−→NaCl然而,为了保持电荷中性,观察到阴离子和阳离子之间的严格比例,因此离子化合物通常遵守化学计量规则,尽管它不是分子化合物。对于过渡到合金并具有混合离子和金属键的化合物,情况可能不再如此。例如,许多硫化物会形成非化学计量的化合物。许多离子化合物被称为盐,因为它们也可以通过阿伦尼乌斯碱(如NaOH)与阿伦尼乌斯酸(如HCl)的中和反应形成NaOH+HCl→NaCl+H2O然后说盐NaCl由酸性剩余Cl-和碱性剩余Na+组成。去除电子以形成阳离子是吸热的,从而提高了系统的整体能量。也可能存在与破坏现有键或添加多个电子以形成阴离子相关的能量变化。然而,阴离子接受阳离子价电子的作用以及随后离子相互吸引释放(晶格)能量,因此降低了系统的整体能量。只有当反应的总能量变化有利时,离子键才会发生。通常,该反应是放热的,但例如氧化汞(HgO)的形成是吸热的。产生的离子的电荷是离子键强度的主要因素,例如,根据库仑定律,盐C+A-由比C2+A2-弱大约四倍的静电力保持在一起,其中C和A表示分别为通用阳离子和阴离子。在这个相当简单的论点中,离子的大小和晶格的特定堆积被忽略了。
离子键的结构
编辑固态的离子化合物形成晶格结构。决定晶格形式的两个主要因素是离子的相对电荷和它们的相对大小。一些结构被许多化合物采用;例如,岩盐氯化钠的结构也被许多碱金属卤化物和氧化镁等二元氧化物所采用。鲍林规则为预测和合理化离子晶体的晶体结构提供了指导
粘合强度
编辑对于固体结晶离子化合物,从气态离子形成固体的焓变称为晶格能。晶格能量的实验值可以使用Born-Haber循环来确定。它也可以使用Born-LANDé方程计算(预测)为静电势能的总和,通过将阳离子和阴离子之间的相互作用和短程排斥势能项相加计算得出。静电势可以用离子间分离和考虑晶体几何形状的常数(马德隆常数)来表示。离核越远,屏蔽越弱。Born-Landé方程对例如氯化钠的晶格能量给出了合理的拟合,其中计算(预测)值为-756kJ/mol,相比之下,使用Born-Haber循环为-787kJ/mol。在水溶液中,结合强度可以通过Bjerrum或Fuoss方程描述为离子电荷的函数,而不依赖于离子的性质,例如极化率或大小。盐桥的强度通常通过测量分子之间的平衡来评估含有阳离子和阴离子位点,最常见于溶液中。水中的平衡常数表明每个盐桥的加性自由能贡献。另一种识别复杂分子中氢键的方法是晶体学,有时也包括核磁共振光谱学。水中的平衡常数表明每个盐桥的加性自由能贡献。另一种识别复杂分子中氢键的方法是晶体学,有时也包括核磁共振光谱学。水中的平衡常数表明每个盐桥的加性自由能贡献。另一种识别复杂分子中氢键的方法是晶体学,有时也包括核磁共振光谱学。定义离子键强度的吸引力可以通过库仑定律建模。离子键强度通常(引用范围不同)在170和1500kJ/mol之间。
极化功率效应
编辑纯离子化合物的晶格中的离子是球形的;然而,如果正离子很小和/或带高电荷,它会扭曲负离子的电子云,这在Fajans的规则中进行了总结。负离子的这种极化导致两个原子核之间额外的电荷密度增加,即部分共价。较大的负离子更容易极化,但这种效应通常仅在涉及带3+电荷的正离子(例如,Al3+)时才重要。然而,2+离子(Be2+)甚至1+(Li+)显示出一些极化能力,因为它们的尺寸非常小(例如,LiI是离子型但存在一些共价键)。请注意,这不是离子极化效应,它指的是由于施加电场而导致晶格中的离子位移。
与共价键的比较
编辑在离子键合中,原子通过带相反电荷的离子的吸引力而结合,而在共价键合中,原子通过共享电子来结合以获得稳定的电子构型。在共价键合中,每个原子周围的分子几何形状由价壳电子对排斥VSEPR规则决定,而在离子材料中,几何形状遵循最大堆积规则。可以说共价键更具方向性,因为不遵守最佳键角的能量损失很大,而离子键则没有这种损失。没有共享的电子对相互排斥,离子应该尽可能有效地堆积。
这通常会导致更高的配位数。在NaCl中,每个离子有6个键,所有键角均为90°。在CsCl中,配位数为8。纯离子键不存在,因为键中所涉及的实体的接近允许它们之间在一定程度上共享电子密度。因此,所有离子键都具有一些共价特性。因此,在离子特征大于共价特征的情况下,键合被认为是离子的。参与键合的两种原子之间的电负性差异越大,它的离子性(极性)就越大。具有部分离子和部分共价特征的键称为极性共价键。例如,Na-Cl和Mg-O相互作用具有百分之几的共价键,而Si-O键通常是~50%离子键和~50%共价键。鲍林估计1.7的电负性差异(在鲍林量表上)对应于50%的离子特性,因此差异大于1。对于具有四极核(2H、14N、81,79Br、35,37Cl或127I)的原子,可以直接测量共价键中的离子特性。这些原子核通常是NQR核四极共振和NMR核磁共振研究的对象。核四极矩Q和电场梯度(EFG)之间的相互作用通过核四极耦合常数来表征QCC=e2qzzQ/h其中eqzz项对应于EFG张量的主成分,e是基本电荷。反过来,当QCC值通过NMR或NQR方法准确确定时,电场梯度为描述分子中的键合模式开辟了道路。一般来说,当离子键发生在固态(或液态)状态时,不可能谈论两个单独原子之间的单个离子键,因为将晶格保持在一起的内聚力具有更集体的性质。这在共价键的情况下完全不同,我们通常可以说位于两个特定原子之间的不同键。然而,即使离子键结合了一些共价键,结果也不一定是局部特征的离散键。在这种情况下,产生的键合通常需要用由跨越整个晶体的巨大分子轨道组成的能带结构来描述。因此,固体中的结合通常保持其集体性而不是局部性。当电负性差减小时,
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/151136/
