甲烷[wán](英文名methane),是最简单的有机化合物,分子式为
发现历史
编辑甲烷的发现
1776年11月,意大利物理学家伏打(A.Volta) ,在意大利北部科摩(Como)湖的淤泥中收集到一种气体。他点燃了这一气体火焰呈青蓝色,燃烧较慢,需要10-12倍体积的空气才会燃烧爆炸,不同于可燃性空气(氢气)的燃烧。提出原子论的英国化学家道尔顿也和伏打一样收集了沼气,并进行了研究。1790年英国医生奥斯汀(W.Austin)发表燃烧甲烷和氢气的报告。他测定了甲烷比氢气重。而且氢气燃烧生成水,甲烷燃烧生成水和二氧化碳。他确定甲烷是碳和氢的化合物。
甲烷的研究
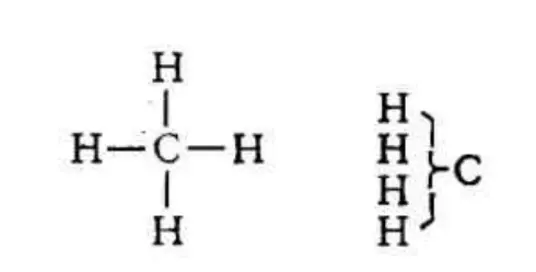
1808年,原子论创立者约翰·道尔顿(John Dalton)认为甲烷分子是由两个氢原子和一个碳原子构成的,并用:
 表示甲烷的分子结构。继道尔顿之后,1813年,瑞典著名学者伯齐利乌斯(Jacob Berzelius)将元素符号引入有机化学 。1857—1858年,德国化学家凯库勒(FriedrichA·Kekule)提出了有机物分子中碳原子为四价 。1861年,俄国化学家布特列洛夫(Butlerov, AleksANDr)提出了化学结构理论的基本思想。这些理论的确立,为人们研究甲烷分子的结构提供了理论依据,人们就在这些理论基础上相继提出了:
表示甲烷的分子结构。继道尔顿之后,1813年,瑞典著名学者伯齐利乌斯(Jacob Berzelius)将元素符号引入有机化学 。1857—1858年,德国化学家凯库勒(FriedrichA·Kekule)提出了有机物分子中碳原子为四价 。1861年,俄国化学家布特列洛夫(Butlerov, AleksANDr)提出了化学结构理论的基本思想。这些理论的确立,为人们研究甲烷分子的结构提供了理论依据,人们就在这些理论基础上相继提出了:
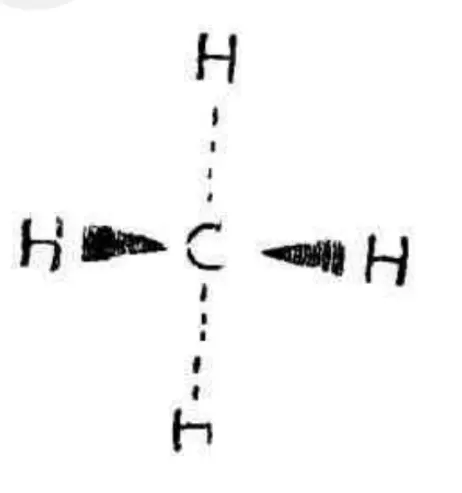 三种甲烷的结构式。到了19世纪,人类对化学的认识上升到了立体化学的层面。1874年,范霍夫(Jacobus HenrICUs van ‘t Hoff)和列别尔(J.A.Le Bel)分别从旋光异构体的数目出发,提出了碳原子具有四面体结构的学说。即甲烷分子中,碳原子位于正四面体的中心,连接氢原子的四个键伸向四面体的四个顶点。这样甲烷的分子结构又可以用:
三种甲烷的结构式。到了19世纪,人类对化学的认识上升到了立体化学的层面。1874年,范霍夫(Jacobus HenrICUs van ‘t Hoff)和列别尔(J.A.Le Bel)分别从旋光异构体的数目出发,提出了碳原子具有四面体结构的学说。即甲烷分子中,碳原子位于正四面体的中心,连接氢原子的四个键伸向四面体的四个顶点。这样甲烷的分子结构又可以用:
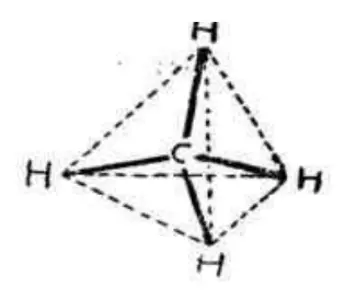 来表示了。但范霍夫提出的学说遭到了强烈的批判。后来,近代X-射线和电子衍射进一步证明了甲烷正四面体结构,而且根据H-C-H的键角就为109°28’,也证明甲烷分子是一个正四面体的立体结构。1916年美国化学家路易斯(GilBERT Newton Lewis)提出了共价学说,建立了经典的共价键理论(又称八隅体理论),这时候甲烷的分子结构变为:
来表示了。但范霍夫提出的学说遭到了强烈的批判。后来,近代X-射线和电子衍射进一步证明了甲烷正四面体结构,而且根据H-C-H的键角就为109°28’,也证明甲烷分子是一个正四面体的立体结构。1916年美国化学家路易斯(GilBERT Newton Lewis)提出了共价学说,建立了经典的共价键理论(又称八隅体理论),这时候甲烷的分子结构变为:
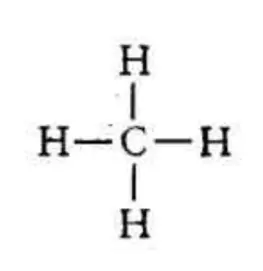
理化性质
编辑物理性质
甲烷在常温下是无色无味的气体,熔点-182.6℃,沸点-161.4℃,相对密度(水=1)为0.42(-164℃),相对蒸汽密度(空气=1)为0.6,饱和蒸气压为53.32kPa(-168.8℃),临界温度为-82.25℃,临界压力为4.59MPa。微溶于水,溶于乙醇、乙醚、苯、甲苯等。
化学性质
在通常情况下,甲烷分子是比较稳定的,跟强酸、强碱或强氧化剂等一般不起反应。但是甲烷的稳定性是相对的,在特定的条件下,也会发生某些反应。
加热分解
在隔绝空气的条件下,把甲烷加热到1000℃~1200℃,能分解成炭黑和氢气。
如果在短时间内加热到1500℃,迅速冷却,甲烷就分解成乙炔和氢气。
取代反应
烷烃分子中的氢原子被其他原子或基团取代的反应,称为取代反应。以氯代反应为例。在室温下,甲烷和氯气的混合物可以在黑暗中长期保存而不起任何反应。但把混合气体放在光亮的地方(在漫射光照射下),就会发生甲烷分子中的氢原子被氯原子取代的反应,黄色的氯气就会逐渐变淡。
反应一般不易停留在这一阶段,生成的一氯甲烷可以继续跟氯气作用,依次生成二氯甲烷、三氯甲烷(又叫氯仿)和四氯甲烷(又叫四氯化碳)。反应式如下:
氧化反应
甲烷易燃烧,燃烧时火焰呈青白色,生成二氧化碳和水,同时放出大量热量。
当甲烷不完全燃烧时会生成炭黑。这是生产炭黑的一种方法。
甲烷在适当的条件下能发生部分氧化,得到氧化产物,如甲醛或甲酸。
裂解反应
把甲烷(实际上是用天然气或焦煤气的甲烷)通入电弧炉中,经过3000℃左右的电弧区,使甲烷加热到1500℃,发生裂解反应生成乙炔和氢气等。然后很快导入骤冷器,被直接喷入的冷水骤冷至100℃以下,阻止其进一步分解,就可得产品乙炔等。
生成合成气
将甲烷与水蒸汽在725℃混和并通过镍催化剂,可以将其转变为一氧化碳和氢气。
应用领域
编辑燃料
甲烷是重要的燃料。以甲烷为主要成分的天然气,在净化处理后有害物质的含量比液态燃料低得多,燃料系统的蒸发排放少。天然气是气态燃料,容易与空气混合,因此燃料燃烧完全,尾气排放污染物也较少。天然气作为优质气体燃料,已有悠久的历史,被大规模开采利用,成为世界第三能源。液化天然气被用于汽车、海上快艇和超音速飞机,不但可以实现高速度,而且可节省燃料。以甲烷为主要成分的沼气,也可作为燃料,主要用于煮饭、点灯,少数用于发电、抽水、加工、开汽车,也用于孵鸡、育蚕、育秧、育雏鸡、烘干粮食,为工业锅炉提供热能。
化工原料
甲烷是发展石油化工的重要一环,是很多化工产品的原料。其利用途径如下:甲烷氧化热解可制稀乙炔,稀乙炔提浓可制各种有机合成产品;经蒸汽转化制氢,可制合成氨、甲醇;经氨氧化可制氢氰酸[qīng qíng suān],由此可制多种有机合成产品,如丙烯酸甲酯、三聚氯氰等;经氯化可制一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷;经氧化可制甲醛;经硝化可制硝基甲烷;经硫化可制二硫化碳;经裂解可制炭黑等。
其他领域
在电子制造领域,高纯甲烷可用于非晶硅太阳电池制造,用作太阳能电池、非晶硅膜气相化学沉积的碳源,用于大规模集成电路干法刻蚀或等离子刻蚀气的辅助添加气。甲烷可用作生产可燃气体报警器的标准气、校正气,还可以及医药化工合成的生产原料。在医疗上,甲烷主要应用于特定种类的肺扩散实验混合气的标准气、成分气。
生理作用
编辑,这种内源性
具有保护细胞膜免受活性氧(reactive oxygen SPecies, ROS)的攻击以及促进细胞膜修复的作用。此外,外源性
具有较强的抗炎、抗氧化、抗凋亡的生物学效 应,提高脑、心脏、肝脏等多种组织器官的抗氧化能力,减轻其氧化应激损伤和炎症损伤的程度,对多种临床疾病的治疗具有研究和应用价值。
制备方法
编辑实验室制备
使用无水醋酸钠(
)和碱石灰在硬质试管中直接混合加热是大多数高校教材采用的制备方法,主要反应:
工业制备
细菌分解法
将有机质放入沼气池中,控制好温度和湿度,甲烷菌迅速繁殖,将有机质分解成甲烷、二氧化碳、氢、硫化氢、一氧化碳等,其中甲烷占60%-70%。经过低温液化,将甲烷提出,可制得廉价的甲烷。
污水厌氧处理生产甲烷
在污水厌氧处理中。在厌氧状态下,二氧化碳、氢气、产酸菌(非产甲烷菌)和产甲烷菌共同作用,产生甲烷。
分离法
分布情况
编辑自然分布
大气来源
自然来源(共计30%):湿地21%,白蚁3%,海洋2%,其他3%。人为来源(共计70%):天然气16%,反刍动物[fǎn chú dòng wù]16%,水田12%,生物燃料燃烧8%,废弃物填埋8%,其他10%。
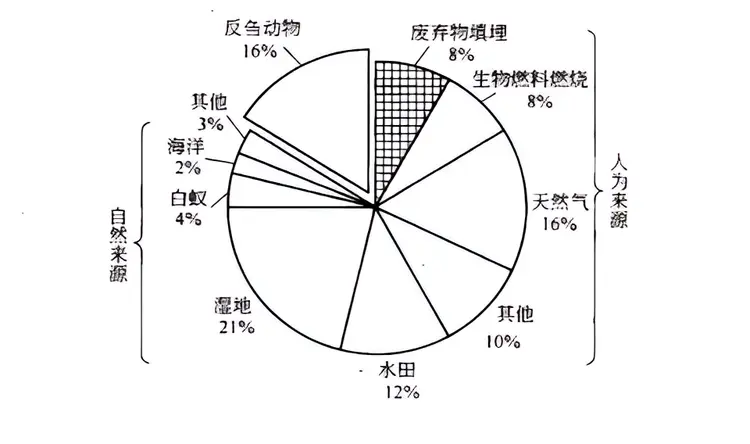
大气中甲烷来源
矿产分布
甲烷是天然气、沼气、坑气主要成分,自然界中储量大,分布较广但不均衡。
其他分布
其他星球,如火星、土卫二也存在甲烷。
分子结构
编辑在甲烷分子中,碳原子采取sp杂化。4个氢原子的s轨道与碳原子的4个sp杂化轨道正面重叠,形成4根C-H键。由于碳原子sp杂化轨道呈正四面体构型,所以,甲烷分子也是正四面体构型。H-C-H为109°28′,C-H键的键长为110pm。甲烷是分子晶体,分子间存在共价键。因为C原子吸引电子的能力强于H原子(H原子电子层中的电子已饱和),因此电子更偏向C原子;H由于偏离电子而显正价,C由于偏向电子而显负价。

甲烷的正四面体模型
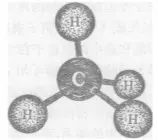
甲烷的凯库勒模型
环境影响
编辑环境污染
泄露、不正当的使用等会对地表水、土壤、大气和饮用水造成污染
温室效应
2018年4月2日,美国能源部劳伦斯伯克利国家实验室的研究人员,利用俄克拉何马州南大平原观测站十年来获得的对地球大气的综合观测数据,首次直接证明了甲烷导致地球表面温室效应不断增加。研究人员称,21世纪初,大气中甲烷的浓度停滞不前,温室效应也遵循同样的模式;但从2007年开始,甲烷浓度开始上升的同时,其导致的温室效应也水涨船高。温室气体甲烷——由奶牛和垃圾场产生。这些温室气体比二氧化碳效力强得多,根据相关机构的研究,以单位分子数而言,甲烷的温室效应要比二氧化碳大上25倍,而最新的计算方式甚至得出甲烷的温室效应比二氧化碳强72倍。但是甲烷在大气中存留的时间要短得多,仅留存大约十年左右。
安全事宜
编辑消防相关
易燃,与空气混合能形成爆炸性混合物,遇明火或热源有燃烧爆炸的危险。当空气中的甲烷浓度达到5%到15%时,遇明火或静电会爆炸。甲烷与五氧化溴[xiù]、氯气、次氯酸、三氟化氮、液氧、二氟化氧及其它强氧化剂接触剧烈反应。
健康相关
皮肤接触液化本品,可致冻伤。甲烷是一种窒息剂。若空气中的甲烷含量达到25% ~30%时就会使人发生头痛、头晕、恶心、注意力不集中、动作不协调、乏力、四肢发软等症状。若空气中甲烷含量超过45% ~50%时,就会因严重缺氧而出现呼吸困难、心动过速、昏迷以至窒息而死亡。
急救措施
若起火。用雾状水、泡沫、二氧化碳、干粉灭火。切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。若冻伤。将患部浸泡于保持在38~42℃的温水中复温。不要涂擦。不要使用热水或辐射热。使用清洁、干燥的敷料包扎。如有不适感,就医。若吸入。迅速脱离现场至空气新鲜处,保持呼吸道通畅。若有呼吸困难者,应给输氧。若有呼吸、心跳停止者,立即进行心肺复苏术并就医。若泄露。应消除所有点火源。根据气体扩散的影响区域划定警戒区,无关人员从侧风、上风向撤离至安全区。建议应急处理人员戴正压自给式呼吸器,穿防静电服。作业时使用的所有设备应接地。禁止接触或跨越泄漏物。尽可能切断泄漏源。若可能翻转容器,使之逸出气体而非液体。喷雾状水抑制蒸气或改变蒸气云流向,避免水流接触泄漏物。禁止用水直接冲击泄漏物或泄漏源。防止气体通过下水道、通风系统和限制性空间扩散。隔离泄漏区直至气体散尽。
GHS制度
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/1230726/
