烷[wán]烃(英语名:Alkane)是仅由碳氢原子通过碳碳单键和碳氢单键组合成的化合物,称为饱和烃,可分为链烷烃和环烷烃。其中链烷烃是指分子中不存在环状结构的烷烃,环烷烃则是分子中存在环状结构的烷烃,可进一步分为单环烷烃和多环烷烃。其中链烷烃结构通式为CnH2n+2(n为碳原子数);环烷烃中的单环烷烃的结构通式为CnH2n(n为碳原子数),多环烷烃类别较多,无法归纳统一的结构通式。
物理性质
编辑聚集状态
常温常压下,碳原子数小于5的烷烃为气态,碳原子数在5-16之间的烷烃为液态,含17个碳原子以上的烷烃为固体。
沸点
烷烃的沸点随碳原子数的增加而升高,因为同系物之间相对分子质量增大,范德华力相应增大。对碳原子数少的烷烃来说,每增加一个
,对相对分子质量影响比较大,引起沸点的变化也会比较大;对于含碳原子数多的烷烃,每增加一个
对相对分子质量影响较小,引起沸点的变化也会比较小。如甲烷比乙烷的沸点低73℃,而癸烷的沸点只比十一烷低了22℃。烷烃的沸点还受分子的对称性影响,含支链的烷烃形状接近球形,分子间的接触面变小,范德华力变小,所以含支链的烷烃沸点低于相同分子质量的直链烷烃。
气味
低沸点的烷烃为无色液体,有特殊气味;高沸点烷烃为粘稠状液体,无味。
密度
烷烃的密度随相对分子质量增大而增大,这也是分子间相互作用力的结果,密度增加到一定数值后,相对分子质量增加而密度变化很小。
熔点
直链烷烃的熔点随碳原子数的增加而升高,但相邻偶数碳原子的直链烷烃熔点大于奇数碳原子的直链烷烃。需要注意的是,随着烷烃相对分子质量的增加,两者的差异会逐渐变小直至趋于一致。相同碳数的条件下,支链烷烃的沸点比直链烷烃低,原因是支链烷烃分子晶格排列不如直链烷烃紧密,分子间作用力降低。
溶解度
遵循相似相溶原则,烷烃难溶于极性溶剂水,易溶于非极性或弱极性有机溶剂。
环烷烃
与碳原子数相等的链烷烃相比,环烷烃的沸点、熔点和密度均要高一些。这是因为链形化合物可以比较自由地摇动,分子间不紧凑,容易挥发,所以沸点低一些。由于这种摇动,比较难以在晶格内做有次序的排列,所以熔点也低一些。由于没有环的牵制,链形化合物的排列也较环形化合物松散些,所以也低一些。一些链烷烃和环烷烃物理常数如下:
光谱特征
红外光谱
在红外光谱里,烷烃分子中的C一H伸缩振动的吸收峰大约在3000-2800cm,而C-H弯曲振动的吸收峰大约在1475-1300cm,其中,甲基在1375cm左右处有一特征吸收峰;亚甲基在1465cm左右出现特征峰。C-H的面内摇摆振动大约在710-750cm出现吸收峰。若多个CH2成直链时,该区域的吸收峰向低波数方向移动。如一CH2CH2一在734-743cm处出现吸收峰,若四个以上CH2成直链时,会在722-724cm处出现吸收峰。
核磁共振谱
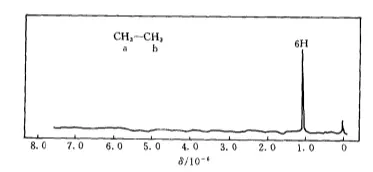
烷烃分子中只含有C和H两种元素所生成的
键,一般为非极性分子,所以HNMR谱非常简单,如图所示乙烷的HNMR图。乙烷CH3-CH3中的6个氢质子都是等性的,相互之间无自旋耦合现象,故为相当于6个质子的一个单峰。
大约为1。
化学性质
编辑因为碳和氢的电负性相近,烷烃中的C-H和C-C键相对稳定,难断裂,所以一般情况下烷烃具有极大的化学稳定性。烷烃与强酸、碱以及常见还原剂、氧化剂均不发生反应;但在光热或者催化剂的作用下进行键均裂的自由基反应。
氧化反应
烷烃中的三级氢(R3H)能与氧发生自由基反应:
所有烷烃都可以燃烧,完全燃烧时会生成水和二氧化碳,同时放出大量的热。烷烃燃烧反应通式:
如果氧气量不足,会生成CO,甚至是C。以甲烷为例:
氧气不足时,反应如下:
卤代反应
烷烃可在光照或者高温条件下与氯或者溴进行自由基取代反应,得到对应的卤代烃。以甲烷为例:
甲烷的卤代反应很难停留在单一取代物,条件许可能够得到多卤代物。
如果想获得某一类取代产物,可通过控制甲烷和氯的投料比来实现。
异构化和裂化反应
异构化反应可以把直链烷烃或者带较少支链的烷烃异构转为带较多支链的烷烃,即将烷烃的一种异构体转化成另一种异构体。如:
裂化反应是在烷烃隔绝氧气的条件下进行的热分解反应,分子量大的烷烃通过C-C或C-H键的断裂生成分子量小的烷烃和烯烃和部分异构化产物。催化剂可以降低裂化反应条件,让反应在较低温度下发生。
硝化反应
烷烃的硝化反应和烷烃的卤代反应类似,取代反应。烷烃在高温下用浓硝酸、N2O4或NO2直接硝化可制得硝基烷。例如:
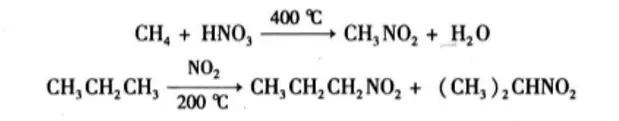 但长碳链的烷烃在高温硝化时,常伴随有碳碳键的断裂,生成一些低级的硝基化合物,不易纯化。工业上可将得到的混合物不用分离,直接可用做溶剂。
但长碳链的烷烃在高温硝化时,常伴随有碳碳键的断裂,生成一些低级的硝基化合物,不易纯化。工业上可将得到的混合物不用分离,直接可用做溶剂。
磺化反应
烷烃在高温下可以和硫酸反应,生成烷基硫磺酸。例如乙烷和硫酸反应生成乙磺酸:
另外,长链烷烃的钠盐可以作为洗涤剂,如十二烷基磺酸钠。磺化反应和卤代反应相似,叔碳原子上的氢原子最容易被磺化,仲碳原子上的氢次之,伯碳原子上的氢最难。
氯磺化反应
高级烷烃可在光照下和硫酰氯反应,生成烷基磺酰[xiān]氯,该反应则称为氯磺化反应。烷基硫酰氯经过水解,可以生成烷基磺酸,以及上面提到的洗涤剂。上述过程反应式如下:
氯磺化反应的机理和氯化相似:
分布情况
编辑烷烃在宇宙间分布众多,其中分布最多的是甲烷,而极少见到由50个碳原子以上所构成的烷烃。烷烃分布于太阳系间许多星球的大气层,有些占了较多的比例,例如天王星(2.3%)、土卫六(5%),但在大多数星球上分布较少,如地球、火星、土星等。地球上的烷烃多为天然气和石油。尽管各地区的天然气成份有所不同,但是,大多都含有约75%的甲烷,15%的乙烷及5%的丙烷等低级烷烃和约5%的高级烷烃。石油的主要成份也是含碳数不等的烷烃的混和物。中国的石油和天然气的资源十分丰富,为发展中国的燃料工业和化学工业提供了取之不尽的原料资源。烷烃还存在于动植物体中,例如某些蔬菜中(大头菜等)含有烷烃。某些昆虫的外激素是烷烃。例如,有一种蚁,通过分泌一种有气味的物质来传递警戒信息,经分析可知,这种物质中含有正十一烷和正十三烷。又如雌虎峨的性外激素是2-甲基十七烷。人们可以合成这种激素,利用它把雄虎峨引入捕集器中将其杀死。昆虫激素是近期发展起来的第三代农药,它往往具有专一性的特点,所以可以用它来杀死某一种昆虫而又不能伤害其他昆虫。热带假丝酵母氧化烃类能力强,可利用煤油,在正烷烃C7~C24的培养基中培养,只能同化壬烷。在230~290℃石油馏分的培养基中,经22h后,可得到相当于烃类重量92%的菌体,是石油蛋白生产的重要酵母。烷烃可以通过细菌产生,产甲烷菌作为一个生理和表型特征独特的类群,其突出的特征是能够产生甲烷。它们生活在极端的厌氧环境中:海洋、湖泊、河流沉积物、沼泽地、稻田和动物肠道,与其他类群细菌互营发酵复杂有机物而产生甲烷。
同系物和同分异构现象
编辑同系物
烷烃中最简单的是甲烷,分子式是CH4,随碳原子数逐渐递增,可以得到一系列的烷烃:甲烷、乙烷、丙烷、丁烷、戊烷等,分子式:CH4、C2H6、C3H8、C4H10、C5H12等。以上的一系列烷烃中,相邻的两个化合物之间的组成差是CH2,称为同系差。在有机化合物中,把结构相似、在分子组成上相差1个或几个CH2原子团的一系列化合物称为同系列。同系列中的化合物互称为同系物。烷烃分子随着碳原子数的增加,碳链增长,氢原子数也随之增多。如果碳原子数目是n,则氢原子数目是2n+2,所以烷烃的组成通式可用CnH2n+2表示。
同分异构现象
烷烃的同分异构现象主要有碳链异构和构象异构,碳链异构是指由于碳原子结合的顺序不同,从而产生直链烷烃和带支链的烷烃的异构现象。烷烃中除甲烷、乙烷、丙烷没有碳链异构现象外,其余烷烃都有碳链异构,例如丁烷有两种,正丁烷和异丁烷,戊烷有三种异构体,正戊烷、2-甲基丁烷和2,2-二甲基丙烷。随着烷烃分子碳原子数的增加,异构体的数目迅速增多。例如己烷有5种,庚烷有9种,辛烷有18种,癸烷有75种之多。
命名规则
编辑链烷烃的通式为CnH2n+2(n=1,2,3…..),具有相同通式,组成相差n个CH2的化合物为同系物,同系物具有相似的化学性质。
链烷烃的命名
系统命名法
直链烷烃的命名
直链烷烃可直接用“碳原子数+烷”来表示。对于碳原子数在1~10的烷烃,可以依次用”甲乙丙丁戊己庚辛壬癸”表示。如果直链烷烃含有的碳原子数超过10,则用数字表示。比如含5个碳原子的直链烷烃为戊烷,含有12个碳原子的直链烷烃为十二烷。下表是常见正烷烃的中英文名称:表中,正(n-)代表直链烷烃,可省略。
支链烷烃的命名
碳原子的级
伯碳,用1℃表示:碳原子与一个碳相连,1℃上的氢为一级氢,记作1°H。仲碳,用2℃表示:碳原子与两个碳相连,2℃上的氢为一级氢,记作2°H。叔碳,用3℃表示:碳原子与三个碳相连,3℃上的氢为一级氢,记作3°H。季碳,用4℃表示:碳原子与四个碳相连。
烷基的名称
命名原则和步骤
1.寻找最长的碳链作为主链,根据碳原子数命名主链,如果支链烷烃中存在多个相同碳数的碳链,则选择侧链数最多的碳链作为主链。如果主链碳数为4个,命名为丁烷,如果主链碳数为12个,则命名为十二烷。2.从最近的取代基位置进行编号,当有多种编号方案时,需要逐项对比不同方案取代基的编号,选择最先遇到的取代基,位次最小的方案。用数字1,2,3…表示取代基的位置。同时要用-将数字和文字隔开。3.如果碳链上存在两个以上相同的取代基,在取代基前加入中文数字:一、二、三…,例如:三甲基,并加在取代基前面,通过“,”将中文数字和取代基隔开。例如:
命名:2,3,4-三甲基己烷。
普通命名法
使用普通命名法对烷烃进行命名时,对直链烷烃的命名和系统命名一致。对于存在支链的烷烃,“正”表示烷烃无分支,“异”表示端链有
结构,“新”表示端链有
结构。例如戊烷的三个同分异构体普通命名法:
正戊烷
异戊烷
新戊烷普通命名法只适用于5个碳原子以下的同分异构体,正、异、新在命名多于5个碳原子的烷烃时就比较困难了。
衍生物命名法
烷烃的衍生物命名法以甲烷为母体,其他部分均作为甲烷的取代基进行命名。例如:
使用衍生物命名法叫做:二甲基正丙基异丙基甲烷。
单环烷烃的命名
无取代基的单环烷烃命名
只有一个环的环烷烃称为单环烷烃。环上没有取代基的环烷烃命名时只需在相应的烷烃前加环,英文名称只需在相应的英文名称前加cyclo。例如:
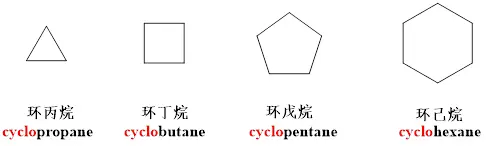
无取代基的单环烷烃命名
有取代基的单环烷烃命名
环上有取代基的单环烷烃命名分两种情况。环上的取代基比较复杂时,应将链作为母体,将环作为取代基,按链烷烃的命名原则和命名方法来命名。例如:

2-甲基-4-环己基己烷
而当环上的取代基比较简单时,通常将环作为母体来命名。例如:

乙基环己烷
当环上有两个或多个取代基时,要对母体进行编号,编号仍遵守最低系列原则。例如:

1,4-二甲基-2-乙基环己烷
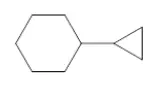
多环烷烃的命名
含有两个或多个环的环烷烃称为多环烷烃。环系各以环上一个碳原子用单键直接相连而成的多环烷烃称为集合环烷烃;两个环共用两个或多个碳原子的多环烷烃称为桥环烷烃;单环之间共用一个碳原子的多环烷烃称为螺环烷烃。多环烷烃的命名较为复杂,三种类别的多环烷烃命名各有区别,此处只做简单介绍。如集合环烷烃命名方法,大环作母体,小环作取代基,名称:1-环丙基环己烷。
 桥环烷烃,根据碳断链确定环数,继而将不包括桥头碳的桥头碳之间的碳原子数由多到少排在放括弧内并用圆点隔开,最后写上包括桥头碳在内的环烃碳原子总数的烷烃名称,名称二环[1.1.0]丁烷。
桥环烷烃,根据碳断链确定环数,继而将不包括桥头碳的桥头碳之间的碳原子数由多到少排在放括弧内并用圆点隔开,最后写上包括桥头碳在内的环烃碳原子总数的烷烃名称,名称二环[1.1.0]丁烷。
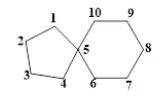
 螺环烷烃,编号从端螺原子相连的小环上的碳开始顺序编号,命名时先写词头螺,再在方括弧内按编号顺序写出除螺原子外的环碳原子数,数字间圆点隔开,最后写出包括螺原子在内的碳原子数烷烃名称,名称螺[4.5]癸烷。
螺环烷烃,编号从端螺原子相连的小环上的碳开始顺序编号,命名时先写词头螺,再在方括弧内按编号顺序写出除螺原子外的环碳原子数,数字间圆点隔开,最后写出包括螺原子在内的碳原子数烷烃名称,名称螺[4.5]癸烷。
制备方法
编辑碳氢化合物的主要来源是石油和天然气。天然气中主要含有甲烷(最多)、乙烷和丙烷,以及少量的高级烃。石油中则含有1~50个碳原子的链烷烃和环烷烃,个别产地的石油还有芳香烃。
实验室制备
烯烃催化氢化,反应式:
还原卤代烃,一般选用的还原剂有四氢锂铝、催化氢化、Zn+酸等。例如:
卤代烃和金属有机物偶联反应(伍尔兹偶联,Wurtz-Fittig),反应式:
科里-豪斯(Corey–House)反应,反应分三步,反应式:
科尔伯(Kolbe)电解法,在弱酸或者中性溶液中,电解高浓度羧酸盐获得烷烃。
工业制备
工业上获取烷烃的方式主要是三种:烯烃催化加氢制取、石油分馏获取和费托合成。烯烃催化加氢制取成本较高,所以工业上一般通过石油分馏和费托合成制取烷烃。
石油分馏
石油分馏得到的产物大致如下:
石油分馏后物质的作用及用途
费托合成
费托合成是以合成气为原料,在催化剂和适当反应条件下合成以烷烃为主的烃类液体燃料的过程,是将煤、天然气和生物质转化为烃类液体燃料的核心技术。费托合成烷烃生成反应如下所示,工业上用铁作催化剂。基于最佳选择性要求,反应过程应该在等温下进行,为此要有效地移出反应热。nCO+2nH2→[-CH2-]n+nH2O
生物制备
沼气主要成分是甲烷,其制备过程是将生物质与空气隔绝,用厌氧细菌(又称嫌气细菌)发酵而产生甲烷。厌氧细菌生长在各种缺氧的环境中,如下水污泥、沼泽、垃圾堆、动物的消化系统中。热化学气化是指将固体燃料如媒碳、木质废弃物、农作物残渣等与空气隔绝,加热分解以产生可燃气体。
应用领域
编辑烷烃在农医药、国防等领域具有重要的应用价值,日常生活中汽车飞机使用的燃料以及实验室中使用的溶剂都离不开烷烃。
溶剂
某些烷烃的取代物可以作为溶剂,在工业上是很有用的,可以用于溶解假漆、醋酸纤维、合成橡胶、及其他有机物。如石油醚(低级烷烃混合物)不溶于水,可溶解大多数有机物,特别能溶解油和脂肪,因此常用它做溶剂。
燃料
烷烃的主要用途之一是作为内燃机的燃料,例如小分子烷烃的硝基化合物都是可燃的,衡量燃料质量优劣的标准是辛烷值,通过异构化或裂化反应,可以提高汽油的辛烷值。烷烃的主要作用是做燃料,石油馏分的主要用途如下:1.C₁~C₄(40℃以下馏分)石油气,作为燃料,广泛应用的清洁能源天然气中含有大量的甲烷;2.C₅~C₁₁(40℃~200℃时的馏分)汽油,可作为燃料也可作为化工原料;3.C₉~C₁₈(150℃~250℃时的馏分)柴油,作燃料。
制作炸药
烷烃硝化生成的硝基烷烃可以制作炸药。例如在硝基甲烷中添加多酸多缩糖可以制作火箭发射剂,将硝基甲烷加入过氯酸脲[niào]中可以制作能在水下使用的炸药。
医药
液体石蜡主要成分是18~24个碳原子的液体烷烃的混合物,是透明的液体。不溶于水和醇,能溶于醚和氯仿中。液体石蜡性质稳定,精制的液体石蜡在医药上常用作肠道润滑的缓泄剂。凡士林是液体石蜡和固体石蜡的混合物,呈软膏状半固体,不溶于水,溶于醚和石油醚。因为它不能被皮肤吸收,而且化学性质稳定,不易和软膏中的药物反应,所以在医药上常用作软膏基质。
科研
正烷烃是构成石油的主要组分之一,广泛分布于古代沉积岩、现代沉积物以及各种生物体中。长期以来,人们对于正烷烃的地球化学习性及其与石油生成、运移和变质的关系较为关注。饱和烃分布模式和长链正构烷烃碳、氢同位素组成逐渐成为风成沉积序列中古气候、古环境研究的重要代用指标。
结构
编辑在烷烃分子中,碳原子形成4个完全相同的SP杂化轨道。碳氢键和碳碳键是由碳的sp杂化轨道分别与氢原子的1s轨道和其他碳的杂化轨道沿键轴方向发生“头碰头”轴向重叠形成的,这种重叠方式形成的键称为
键。烷烃所有的碳碳键和碳氢键都是
键。甲烷是烷烃中最简单的分子,分子中的碳原子以4个sp杂化轨道分别与4个氢原子的s轨道重叠,形成4个C-H
键,并且相互间的夹角为109.5°,呈正四面体结构。十二种烷烃的分子式及三维模型如下:
安全事宜
编辑火灾危险
烷烃均可燃烧,其中C1到C4的烷烃为极易燃气体,遇热可能会爆炸,存储时需要远离火花、明火、热源等。以壬烷、庚烷等为代表的液态烷烃,其蒸气与空气混合会形成爆炸性混合物。
健康危害
吸入丙烷、乙烷或丁烷的混合气体会导致急性中毒,引起头晕、头痛、恶心、呕吐等症状,严重时会导致意识丧失。长期低浓度吸入丙烷、丁烷,会引发神经衰弱综合症、脉搏不稳、多汗等症状。液态烷烃如壬烷,吸入蒸气后会引发神志不清、咳嗽等症状,将液态壬烷吸入呼吸道会引发吸入性肺炎。
环境危害
烷烃的环境污染是伴随着石油产品的开发、应用而出现的。在大气中,烷烃主要存在于煤炭矿坑的空气中、天然气及石油气中、各种工业可燃气体应用场合的空气中、石油炼制和加工场合的空气中。在水体中,在石油采集、炼制废水中含有大量的烷烃。水上原油运输、输送过程中漏油和溢油造成的地面水污染,另外,城市因路面冲刷,使得污水中含有一定量的烷烃类物质。在土壤中,烷烃的污染是因采油、炼油、石油的应用过程造成的。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587220/
