什么是血管生成
编辑血管生成是从先前存在的血管中形成新血管的生理过程,在血管生成的早期阶段形成。血管生成通过发芽和分裂过程继续脉管系统的生长。血管发生是由中胚层细胞前体和新生血管形成的内皮细胞的胚胎形成,尽管讨论并不总是准确的(尤其是在旧文本中)。发育中的胚胎中的第一批血管通过血管生成形成,之后血管生成负责大多数(如果不是全部)在发育和疾病中的血管生长。
血管生成是生长和发育以及伤口愈合和肉芽组织形成中的正常且重要的过程。然而,这也是肿瘤从良性状态转变为恶性状态的基本步骤,导致血管生成抑制剂在癌症治疗中的应用。血管生成在肿瘤生长中的重要作用于1971年由JudahFolkman首次提出,他将肿瘤描述为“热血沸腾”,说明至少对于许多肿瘤类型而言,冲洗灌注甚至充血是特征性的。
血管生成的类型
编辑发芽血管生成
编辑发芽血管生成是第一个确定的血管生成形式,因此,它比肠套叠血管生成更容易理解。它发生在几个特征明确的阶段。初始信号来自没有脉管系统的组织区域。在这些区域注意到的缺氧导致组织需要营养和氧气的存在,这将使组织能够进行代谢活动。因此,实质细胞会分泌血管内皮生长因子(VEGF-A),它是一种促血管生成生长因子。这些生物信号激活内皮细胞上的受体存在于预先存在的血管中。其次,被激活的内皮细胞,也称为尖端细胞,开始释放称为蛋白酶的酶,这些酶降解基底膜,使内皮细胞从原始(亲本)血管壁逃逸。然后内皮细胞增殖到周围的基质中并形成连接相邻血管的固体芽。正在增殖的细胞位于尖端细胞的后面,被称为茎细胞。这些细胞的增殖使毛细血管芽的长度同时生长。
随着芽向血管生成刺激源延伸,内皮细胞使用称为整合素的粘附分子串联迁移。随着细胞迁移到血管生成部位,这些芽然后形成环,成为成熟的血管腔。发芽以每天几毫米的速度发生,并使新血管能够跨越脉管系统的间隙生长。它与分裂血管生成明显不同,因为它形成全新的血管,而不是分裂现有的血管。
肠套叠血管生成
编辑肠套叠血管生成,也称为分裂血管生成,是通过将现有血管一分为二而形成新血管。
肠套叠首先在新生大鼠中观察到。在这种类型的血管形成中,毛细血管壁延伸到管腔中以将单个血管一分为二。肠套叠性血管生成有四个阶段。首先,两个相对的毛细管壁建立了一个接触区。其次,内皮细胞连接被重组,血管双层被穿孔以允许生长因子和细胞渗透到管腔中。第三,在充满周细胞和肌成纤维细胞的接触区的两个新血管之间形成一个核心。这些细胞开始铺设胶原蛋白纤维进入核心,为血管腔的生长提供细胞外基质。最后,核心被充实,基本结构没有改变。肠套叠很重要,因为它是对现有细胞的重组。它允许毛细血管的数量大量增加,而内皮细胞的数量却没有相应的增加。这在胚胎发育中尤为重要,因为每次新血管发育时都没有足够的资源来创建具有新细胞的丰富微脉管系统。
生理学
编辑机械刺激
编辑血管生成的机械刺激没有很好地表征。关于作用于毛细血管以引起血管生成的剪切应力存在大量争议,尽管目前的知识表明增加的肌肉收缩可能会增加血管生成。这可能是由于运动过程中一氧化氮的产生增加所致。一氧化氮导致血管舒张。
化学刺激
编辑血管生成的化学刺激由各种血管生成蛋白例如整合素和前列腺素进行,包括几种生长因子例如VEGF、FGF。
血管内皮生长因子
血管内皮生长因子(VEGF)已被证明是血管生成的主要贡献者,可增加给定网络中毛细血管的数量。最初的体外研究表明,牛毛细血管内皮细胞在VEGF和bFGF刺激下会增殖并显示出管状结构的迹象,尽管使用VEGF的结果更为明显。VEGF的上调是对运动的生理反应的主要组成部分,其在血管生成中的作用被怀疑是血管损伤的一种可能的治疗方法。体外研究清楚地表明,VEGF是一种有效的血管生成刺激物,因为在这种生长因子的存在下,铺板的内皮细胞会增殖和迁移,最终形成类似于毛细血管的管状结构。VEGF引起内皮细胞中的大规模信号级联。与VEGF受体2(VEGFR-2)结合启动酪氨酸激酶信号级联反应,刺激产生各种刺激血管通透性(eNOS,产生NO)、增殖/存活(bFGF)、迁移(ICAM/VCAM/MMP)的因子最后分化成成熟的血管。机械地,由于流向受影响区域的血流量增加,VEGF随着肌肉收缩而上调。流量的增加也会导致流量的大幅增加VEGF受体1和2的MRNA产生。受体产生的增加意味着肌肉收缩可能导致与血管生成相关的信号级联的上调。作为血管生成信号级联的一部分,NO被广泛认为是血管生成反应的主要贡献者,因为NO的抑制显着降低了血管生成生长因子的作用。然而,在运动过程中对NO的抑制不会抑制血管生成,这表明血管生成反应中还涉及其他因素。
血管生成素
正如小鼠敲除研究所证明的,血管生成素Ang1和Ang2是成熟血管形成所必需的。Ang1和Ang2是蛋白质生长因子,通过结合其受体Tie-1和Tie-2发挥作用;虽然这有点争议,但似乎小区信号主要由Tie-2传输;尽管一些论文也显示了通过Tie-1进行的生理信号传导。这些受体是酪氨酸激酶。因此,当配体结合引起引发磷酸化的二聚化时,它们可以启动细胞信号传导关于关键酪氨酸。
MMP
另一个促进血管生成的主要因素是基质金属蛋白酶(MMP)。MMP有助于降解保持血管壁坚固的蛋白质。这种蛋白水解允许内皮细胞逃逸到间质基质中,如在萌芽血管生成中所见。抑制MMP可防止新毛细血管的形成。这些酶在血管形成过程中受到高度调节,因为细胞外基质的破坏会降低微脉管系统的完整性。
DII4
Delta样配体4(DII4)是一种对血管生成具有负调节作用的蛋白质。Dll4是一种跨膜配体,用于Notch受体家族。已经进行了许多研究来确定类Delta配体4的后果。一项研究特别评估了DII4对肿瘤血管分布和生长的影响。为了使肿瘤生长和发育,它必须具有适当的脉管系统。VEGF通路对脉管系统的发育至关重要,而脉管系统反过来又有助于肿瘤的生长。VEGF和DII4的联合阻断导致抑制肿瘤进展和整个肿瘤的血管生成。这是由于内皮细胞信号传导中的信号传导受阻,从而切断了这些内皮细胞的增殖和发芽。通过这种抑制,细胞不会不受控制地生长,因此癌症在此时停止。然而,如果解除封锁,细胞将再次开始增殖。
第3类信号素
3类信号素(SEMA3)通过调节内皮细胞粘附、迁移、增殖、存活和周细胞募集来调节血管生成。此外,semaphorins可以干扰VEGF介导的血管生成,因为SEMA3s和VEGF-A都竞争结合内皮细胞的神经纤维蛋白受体。因此,SEMA3s和VEGF-A的相对表达水平可能对血管生成很重要。
化学抑制
编辑血管生成抑制剂可以是内源性的,也可以来自外部作为药物或饮食成分。
医学应用
编辑血管生成作为治疗靶点
编辑血管生成可能是对抗以血管形成不良或血管异常为特征的心脏病等疾病的靶点。应用可能抑制或诱导体内新血管生成的特定化合物可能有助于对抗此类疾病。在不应该存在血管的地方存在血管可能会影响组织的机械性能,从而增加失败的可能性。修复或其他代谢活跃的组织中没有血管可能会抑制修复或其他基本功能。几种疾病,例如缺血性慢性伤口,是失败或血管形成不足的结果,可以通过血管局部扩张来治疗,从而为该部位带来新的营养,促进修复。其他疾病,例如与年龄相关的黄斑变性,可能是由血管局部扩张造成的,干扰了正常的生理过程。
血管生成原理的现代临床应用可分为两个主要领域:抗血管生成疗法(血管生成研究始于此)和促血管生成疗法。尽管正在使用抗血管生成疗法来对抗癌症和恶性肿瘤,这需要大量的氧气和营养物质才能增殖,但正在探索促血管生成疗法作为治疗心血管疾病的选择,心血管疾病是心血管疾病的第一大原因。西方世界的死亡。促血管生成方法在人类中的首次应用之一是一项使用成纤维细胞生长因子1(FGF-1)治疗冠状动脉疾病的德国试验。
关于作用机制,促血管生成方法可分为三大类:基因治疗,靶向感兴趣的基因进行扩增或抑制;蛋白质替代疗法,主要操纵血管生成生长因子,如FGF-1或血管内皮生长因子VEGF;和基于细胞的疗法,其中涉及特定细胞类型的植入。
与基因治疗相关的严重的、未解决的问题仍然存在。困难包括将治疗基因有效整合到靶细胞的基因组中,降低与用于植入基因的病毒载体相关的不良免疫反应、潜在毒性、免疫原性、炎症反应和肿瘤发生的风险,以及遗传基因的绝对复杂性。血管生成的基础。人类最常发生的疾病,如心脏病、高血压、糖尿病和阿尔茨海默病,很可能是由许多基因变异的综合影响引起的,因此,注射单一基因可能不会显着有益于此类疾病。
相比之下,促血管生成蛋白疗法使用定义明确、结构精确的蛋白质,具有先前定义的针对疾病状态的最佳个体蛋白质剂量,并具有众所周知的生物学效应。另一方面,蛋白质治疗的一个障碍是递送方式。口服、静脉内、动脉内或肌肉内的蛋白质给药途径并不总是有效,因为治疗性蛋白质可能在进入靶组织之前被代谢或清除。基于细胞的促血管生成疗法仍处于研究的早期阶段,关于最佳细胞类型和使用剂量存在许多悬而未决的问题。
肿瘤血管生成
编辑癌细胞是失去了以受控方式分裂的能力的细胞。恶性肿瘤由一群快速分裂和生长的癌细胞组成,这些癌细胞逐渐产生突变。然而,肿瘤需要专门的血液供应来提供它们所需的氧气和其他必需营养物质,以使其生长超过一定大小(通常为1-2mm3)。
肿瘤通过分泌各种生长因子(例如VEGF)和蛋白质来诱导血管生长(血管生成)。bFGF和VEGF等生长因子可以诱导毛细血管生长进入肿瘤,一些研究人员怀疑毛细血管可以提供所需的营养,从而使肿瘤扩张。与正常血管不同,肿瘤血管扩张为不规则形状。其他临床医生认为,血管生成确实是一种废物途径,会带走快速分裂的癌细胞分泌的生物终产物。在任何一种情况下,血管生成都是从一个小的无害细胞簇(通常被认为与圆珠笔末端的金属球大小差不多)转变为大肿瘤的必要且必要的步骤。肿瘤的扩散或转移也需要血管生成。单个癌细胞可以从已建立的实体瘤中脱离,进入血管,并被运送到远处,在那里它们可以植入并开始继发性肿瘤的生长。现在的证据表明,给定实体瘤中的血管实际上可能是镶嵌血管,由内皮细胞组成和肿瘤细胞。这种镶嵌性允许肿瘤细胞大量脱落到脉管系统中,可能导致恶性肿瘤患者外周血中出现循环肿瘤细胞。这种转移的后续生长也将需要营养和氧气的供应以及废物处理途径。
长期以来,内皮细胞一直被认为在遗传上比癌细胞更稳定。与针对癌细胞的化学疗法相比,这种基因组稳定性赋予了使用抗血管生成疗法靶向内皮细胞的优势,后者迅速突变并获得对治疗的耐药性。出于这个原因,内皮细胞被认为是针对它们的治疗的理想靶标。
肿瘤血管的形成
编辑通过血管生成形成血管的机制是由肿瘤细胞由于突变引起的自发分裂引发的。然后血管生成刺激物被肿瘤细胞释放。然后它们会到达附近已经建立的血管并激活它们的内皮细胞受体。这诱导从脉管系统释放蛋白水解酶。这些酶针对血管上的特定点并导致形成毛孔。这是新血管生长的地方。肿瘤细胞需要血液供应的原因是,如果没有建立的血液供应(相当于大约50-100个细胞),它们的直径不能生长超过2-3毫米。
心血管疾病的血管生成
编辑血管生成代表了治疗心血管疾病的极好的治疗靶点。这是一个强有力的生理过程,它是我们身体对重要器官血液供应减少的自然反应的基础,即新血管生成:产生新的侧支血管以克服缺血性损伤。在心脏缺血动物模型以及外周动脉疾病模型中,已经进行了大量基于蛋白质、基因和细胞疗法的临床前研究。这些早期动物研究中可重复和可信的成功引发了人们的高度热情,即这种新的治疗方法可以迅速转化为西方世界数百万患有这些疾病的患者的临床益处。然而,十年来旨在刺激灌注不足的组织和器官中血管生成的基于基因和蛋白质的疗法的临床测试已经从一个失望变成另一个失望。尽管所有这些临床前读数都为血管生成疗法从动物到人类的转变提供了巨大的希望,但它们都以一种或另一种方式被纳入早期临床试验,
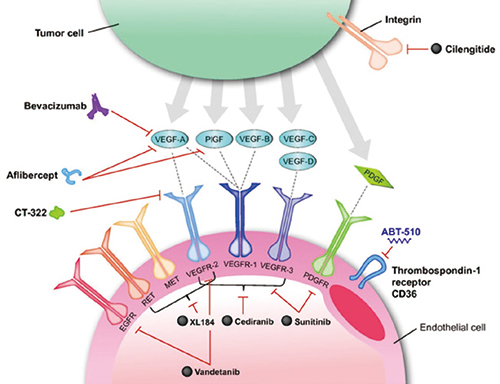
这些失败表明,要么这些是诱导新血管形成的错误分子靶标,要么它们只有在正确配制和给药的情况下才能有效使用,或者它们在整个细胞微环境中的呈现可能在它们的效用中发挥重要作用。可能有必要以模拟自然信号事件的方式呈现这些蛋白质,包括浓度、空间和时间分布,以及它们与其他适当因素的同时或顺序呈现。
练习
编辑血管生成通常与有氧运动和耐力运动有关。虽然动脉发生产生网络变化,使网络中的总流量大大增加,血管生成引起变化,从而允许在很长一段时间内提供更多的营养。毛细血管旨在提供最大的养分输送效率,因此毛细血管数量的增加允许网络在相同的时间内提供更多的养分。更多数量的毛细血管还允许在网络中进行更多的氧气交换。这对于耐力训练至关重要,因为它可以让一个人继续长时间的训练。然而,没有实验证据表明耐力运动需要增加毛细血管来增加最大氧气输送。
黄斑变性
编辑除了刺激血管生成外,VEGF的过表达还导致血管通透性增加。在湿性黄斑变性中,VEGF导致毛细血管增殖进入视网膜。由于血管生成的增加也会导致水肿、血液和其他视网膜液渗入视网膜,导致视力丧失。靶向VEGF通路的抗血管生成药物现已成功用于治疗这种类型的黄斑变性
组织工程构造
编辑从宿主体内血管生成到植入的组织工程结构中是必不可少的。成功的整合通常取决于构建体的彻底血管化,因为它提供氧气和营养并防止植入物中心区域的坏死。PDGF已被证明可以稳定胶原蛋白-糖胺聚糖支架中的血管形成。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/133872/
