人血清白蛋白
编辑人血清白蛋白是在人体血液中发现的血清白蛋白。它是人体血浆中含量最多的蛋白质;它约占血清蛋白的一半。它在肝脏中产生。易溶于水,为单体。
白蛋白运输激素、脂肪酸和其他化合物、缓冲pH值和维持渗透压等功能。
白蛋白在肝脏中合成为前白蛋白原,它具有一个N端肽,在新生蛋白从粗面内质网释放之前被去除。产物原白蛋白又在高尔基体中被切割以产生分泌的白蛋白。
血清中白蛋白浓度的参考范围约为35–50g/L(3.5–5.0g/dL)。它的血清半衰期约为21天。它的分子量为66.5kDa。
白蛋白基因位于4号染色体的4q13.3位点,该基因的突变可导致异常蛋白质。人白蛋白基因从推定的“cap”位点到第一个poly(A)添加位点有16,961个核苷酸长。它被分成15个外显子,对称地放置在3个域内,这些域被认为是由单个原始域的三倍体产生的。
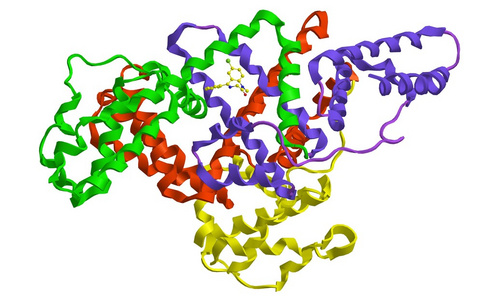
人血清白蛋白(HSA)是一种高度水溶性的球状单体血浆蛋白,相对分子量为67KDa,由585个氨基酸残基、一个巯基和17个二硫键组成。在纳米颗粒载体中,HSA纳米颗粒因其与各种药物分子结合的能力、在储存和体内使用过程中的稳定性、无毒性和抗原性、可生物降解性、可重复性、可放大生产过程和更好地控制释放特性。此外,由于白蛋白分子上有大量药物结合位点,可以将大量药物掺入颗粒基质中。
测量
编辑血清白蛋白通常通过记录与染料(如溴甲酚绿或溴甲酚紫)结合后的吸光度变化来测量。
参考范围
编辑成人(>3岁)人血清白蛋白的正常范围为3.5–5.0g/dL(35–50g/L)。对于三岁以下的儿童,正常范围更广,为2.9–5.5g/dL。
低白蛋白(低白蛋白血症)可能由肝病、肾病综合征、烧伤、蛋白质丢失性肠病、吸收不良、营养不良、妊娠晚期、人工制品、遗传变异和恶性肿瘤引起。
高白蛋白(高白蛋白血症)几乎总是由脱水引起。在某些视黄醇(维生素A)缺乏症的情况下,白蛋白水平可能会升高到正常的高值(例如4.9g/dL),因为视黄醇会导致细胞遇水膨胀。(这也是维生素a过多有毒的原因。)这种肿胀也可能发生在用13-顺式维甲酸(异维甲酸)治疗期间,这是一种治疗严重痤疮的药物,以及其他疾病。在实验室实验中,已经表明全反式维甲酸下调人类白蛋白的产生。
人血清白蛋白的病理学
编辑低白蛋白血症
编辑低白蛋白血症意味着低血白蛋白水平。这可能是由以下原因引起的:
高白蛋白血症
编辑高白蛋白血症是血液中白蛋白浓度增加。通常,这种情况是由于脱水造成的。高蛋白血症也与高蛋白饮食有关。
医疗用途
编辑人白蛋白溶液(HSA)可用于医疗用途,浓度通常为5–25%。
人白蛋白通常用于补充丢失的体液并帮助恢复创伤、烧伤和手术患者的血容量。没有强有力的医学证据表明白蛋白给药(与生理盐水相比)可以挽救低血容量患者或因烧伤或低白蛋白血症而危重的患者的生命。也不知道是否有危重病人可以从白蛋白中受益。因此,CochraneCollaboration建议不应使用它,除非在临床试验中。
在声学液滴汽化(ADV)中,白蛋白有时用作表面活性剂。ADV已被提议作为一种通过闭塞疗法进行的癌症治疗。
人血清白蛋白可用于通过与游离药物/试剂结合来潜在地逆转药物/化学毒性。
人白蛋白也可用于治疗失代偿期肝硬化。
人血清白蛋白已被用作虚弱指数的组成部分。
糖化
编辑长期以来,人们就知道血红蛋白和血清白蛋白等人体血液蛋白可能会发生缓慢的非酶糖基化,主要是通过在赖氨酸(有时是精氨酸)残基的ε-氨基和葡萄糖分子之间形成席夫碱。血液(美拉德反应)。在抗氧化剂的存在下可以抑制该反应。尽管这种反应可能正常发生,但在糖尿病中观察到糖白蛋白升高。
此外,糖基化会导致高级糖基化终产物(AGE)的形成,从而导致异常的生物学效应。AGEs的积累通过改变组织蛋白的结构和功能、刺激细胞反应、通过对AGE蛋白特异的受体和产生活性氧中间体导致组织损伤。AGEs也与DNA发生反应,从而导致突变和DNA转座。蛋白质和碳水化合物的热加工会导致过敏原发生重大变化。AGEs具有抗原性,代表了烹饪或储存食品中发现的许多重要的新抗原。它们还会干扰细胞中一氧化氮的正常产物。
虽然血清白蛋白结构中存在多个赖氨酸和精氨酸残基,但很少有人能参与糖基化反应。
氧化
编辑白蛋白是大多数体液中的主要蛋白质,其Cys34代表体内游离硫醇的最大部分。白蛋白Cys34硫醇以还原和氧化形式存在。在健康年轻人的血浆中,总HSA的70-80%含有还原形式的游离巯基Cys34或巯基白蛋白(HSA-SH)。然而,在以氧化应激为特征的病理状态和衰老过程中,氧化形式或非巯基白蛋白(HNA)可能占主导地位。
白蛋白硫醇与自由基羟基(.OH)、过氧化氢(H2O2)和作为过氧亚硝酸盐(ONOO.)的活性氮物质反应,并已被证明可将Cys34氧化为亚磺酸衍生物(HSA-SOH),它可以回收利用巯基白蛋白;然而,高浓度的活性物质会导致不可逆的氧化为亚磺酸(HSA-SO2H)或磺酸(HSA-SO3H),从而影响其结构。活性氧(ROS)的存在会导致不可逆的结构损伤并改变蛋白质活性。
肾脏损失
编辑在健康的肾脏中,白蛋白的大小和负电荷将其排除在肾小球中的排泄之外。情况并非总是如此,如在某些疾病中,包括糖尿病肾病,有时可能是不受控制或长期糖尿病的并发症,其中蛋白质可以穿过肾小球。丢失的白蛋白可以通过简单的尿检来检测。根据白蛋白的丢失量,患者可能有正常的肾功能、微量白蛋白尿或白蛋白尿。
互动
编辑已显示人血清白蛋白与FCGRT相互作用。
它还可能与尚未鉴定的albondin(gp60)、某对gp18/gp30以及其他一些蛋白质如骨粘连蛋白、hnRNPs、钙网蛋白、cubilin和巨蛋白相互作用。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/135572/
