化学元素(Chemical element)简称元素(element)。元素是所有物质的最基本组成要素,是由不能再被化学反应分解的微观粒子原子组成。元素在其周期表中位置的顺序号数,称为原子序数,它代表原子核电荷数,即核中的质子数,等于核外电子数。同一种化学元素是由质子数相同的同一类原子的总称。由于原子序数反映了原子内部结构,因此,元素的一切性质都与原子序数有关。元素的原子量、放射性及存在丰度等都是由原子核决定的性质,可直接由原子序数推知。
历史
编辑化学元素概念
早在人类文明的初期,人类观察到自然界中形态各异的许多物质,就把性质相同的实物材料视为同一种物质,认为它们含有某种(或某些)相同的成分,并逐步发展到把某些实物或性质当作元素来说明万物的组成,如古代中国的金、木、水、火、土五行说;古代印度的地、水、火、风说等。古希腊亚里士多德则提出水、火、土、气四元素说,认为各种元素是由“干、湿、冷、热”四种“原性”两两组成。但是,也有人认为构成世界的本源是数,或者是理念、道、气、阴阳等,把世界的本源归结为抽象的东西。例如,毕达哥拉斯就认为数是构成世界的本源。
到17世纪,英国科学家R.波义耳在一系列实验基础上作出总结,在1661年为化学元素做出了科学而明确的定义:“它们应当是某种不由任何其他物质所构成的或是互相构成的、原始的和最简单的物质”,“应该是一些具有确定性质的、实在的、可察觉到的实物,用一般化学方法不能再分解为更简单的某些实物。”这个定义为使化学逐步成为一门真正的科学做出了重要的贡献。他根据气体的可压缩性和物质的溶解和挥发性,发展了物质的微粒学说,并提出了火的微粒说,认为金属煅烧后重量加重是由于金属和火微粒的结合。
17世纪末,德国化学家贝歇尔在著作《土质物理》中对燃烧作用有很多的论述。他认为燃烧是一种分解作用,动、植物和矿物燃烧后,留下成分更简单的物质。因此,按照他的理论,不能分解的物质是单质,不会燃烧。关于物质的结构,他略微修改了医药化学家的“硫、汞、盐”三元素学说,认为各种物质都是由3种基本“土质”组成的,不同物质是由于这3种“土质”的成分不同造成的。他认为物体燃烧就是放出其中“油土”的成分。贝歇尔所说的“油土”的成分,即相当于以后的“燃素”。
1703年,贝歇尔的学生德国化学家G.E.施塔尔总结了燃烧中的各种现象及各家观点之后,发表了《化学基础》一书,系统地阐述了“燃素学说”。他认为一切可燃的物质中都含有一种气态的要素,即所谓燃素,它在燃烧过程中从可燃物中飞散出来,与空气结合,从而发光发热。
1772-1785年间,被誉为“近代化学之父”的法国化学家A.L.拉瓦锡在科学实验的基础上第一次提出了“元素”的概念,并以氧和氢为例,称它们不可能通过化学方法分解为更小的成分。他发展了波义耳的元素定义,并确认了氮、氢、氧为元素。1789年,拉瓦锡在其著作《化学概要》中列出了第一张元素表,并把元素分为简单物质、金属物质、非金属物质和成盐土质四大类。
19世纪初,道尔顿在对气体扩散和气体混合现象进行研究的基础上,提出了原子理论,进而又把原子概念与化学分解和化合现象结合起来建立了化学原子论,从理论上成功地解释了反映组成化合物的元素之间定量关系的一系列规律。道尔顿认为,相同元素的原子相同,不同元素的原子不同,有多少种元素,就有多少种原子。他把元素和原子联系在一起,最终建立基于原子理论的元素观念(“元素是相同原子的总称”)。1860年,康尼查罗确立了科学的分子概念,阐明了原子理论和分子理论,使道尔顿的原子概念得以真正确立,原子论的化学元素观念被普遍接受。
化学元素的发现
古代,人们通过感性直观的方法,即凭着经验,用肉眼观察物质及其变化,认识物质的性质而发现了一些元素。如通过燃烧认识碳、硫;通过冶炼和工具的使用认识金、银、铜、铁、锡、铅、锌;通过炼金炼丹发现汞、磷、砷、锑、铋等。
18世纪,随着化学工业的迅速发展,在化学成为一门以实验为基础的科学后,人们接连发现了氢、氮、钛、铬、铂、碲、钨、铀、锰、氯、钴等元素。
19世纪初,人们发明了电解的方法,用这一新技术发现了一系列较活泼的金属,钠、钾、镁、锶、钡,并用钠、钾等活泼金属去还原非金属化合物,发现了新的硼和硅。随着化学分析技术的提高,特别是光谱分析的发明,科学家又继续发现了镉、镧、铟、铽、铒、镱、铊、镝、硒、钌等元素,其中大部分是地球上比较稀少的元素。
19世纪末,人们在对空气的研究中,接连发现了六种新的稀有气体氦、氖、氩、氪、氙、氡。这六种气体的化学性质都很不活泼,称作惰性气体。
到20世纪,随着生产的发展,人们又发现了几种较难于被发现的新元素,这些元素在地球上都很稀少。在1917年,人们发现了镤;1925年发现了铼;1944年发现了钷。
随着原子能工业的发展,人们开始制造人造元素。20世纪中期,人们分别制得了93号至105号的大多数元素,如镎、钚、镅、锔等。到2016年,国际纯粹与应用化学联合会宣布,由俄罗斯、美国和日本科学家制成的4种人造化学元素,获得承认,进入元素周期表,即第113号(Nn)、115号(Mc)、117号(Ts)和118号(Og)。科学家们还在继续制造人造化学元素。
元素符号的发展
元素符号的萌芽可追溯到中古时期的炼金时期,为了保密,他们往往用一些隐语表示某一物质,如:“姹女”“黄芽”“圣水”等,也有用一些图画符号来表示元素或化合物的,这是最早的元素符号。
随着越来越多的物质出现,化学条理化和系统化的需求出现,1787年,拉瓦锡与贝托雷等合作组成了“巴黎科学院命名委员会”,建议每种物质必须有固定的名称,且元素的名称必须尽可能反映出它们的特性和特征。化合物的名称必须能反映它们所含的元素、表示其组成。如酸类和碱类用所含的元素来命名,磷酸、硫酸、钾碱、钠碱等。拉瓦锡成为第一个为元素进行分类的人。
1808年,道尔顿依据他的原子论,认为简单原子都是不可分的实心球体,于是设计用圆圈及其变体表示元素,用元素符号的组合表示复杂原子(化合物)的组成。
1813年,贝采里乌斯认识到道尔顿元素符号和化学式的合理之处,也看到它的缺点。因此建议采用以每种元素的拉丁文名称的开头字母,大写作为元素符号。如果第一个字母相同,那就再取其第二个字母,小写以示区别,如Si-silicium。他还建议化合物的化学式用元素符号表示,每一个元素符号在化学式中各代表一个原子,如二氧化碳记作CO2。贝采里乌斯的化学符号简单明了,元素符号一直沿用至今。但当时由于人们对原子、分子认识的混乱,并没有被广泛接受。直到1860年卡尔斯鲁厄会议贝采里乌斯的化学符号系统被化学界采用。
元素周期律的发展
从中国古代的五行说、古希腊的四元素说开始,人们一直对世界万物的构成物质或元素的分类及它们之间的关系进行探索。拉瓦锡在对元素进行定义后列了一张元素表,把元素分为四类:气体元素、金属元素、非金属元素、能成盐的土质元素。但是他把光和热也作为元素并归入气体元素,把石灰和氧化镁归为土质元素。后来人们又依元素性质而分族,例如把卤素归于造盐元素族,把金、银等不易被空气腐蚀的元素称为贵金属。
德国耶拿大学化学教授德贝莱纳首先注意到碱金属、碱土金属在化学性质上十分相似,似乎存在一种族的特征。经过研究,在当时已知的54种元素中,他发现几个化学性质相似的元素组,每组包括三种元素:锂、钠、钾;钙、锶、钡;氯、溴、碘;硫、硒、碲;锰、铬、铁。每组元素中,中间那个元素的原子量恰好为前后二种元素原子量的算术平均值。1829年他把上述元素的这种关系称为三元素组。
尚古多在1862年提出了元素性质有周期性重复的规律。为说明这一规律,他将元素按原子量大小循序记在一个圆周线分成十六份的圆柱体的螺旋线上,那些性质相似的元素排列在同一垂直线上,从而显示其变化的周期性。
奥德林在1865年排出了以原子量大小为序的新元素表,在横排上出现一些性质相似的元素组,说明元素性质随原子量递增而呈现周期性。他初步排列出元素周期表中的卤族、氧族、氮族等。
1866年,纽兰兹发表了论文《八音律与原子量数字关系的起因》。在文中他按原子量大小给元素编上序号,依次排出了一个元素表,把62种元素排列成类似于音乐乐谱中八音阶的排列图式,来表示元素性质随原子量大小顺序的变化周期性。
到1869年,在63种已知元素中,42种元素有了较精确的原子量。在总结前人工作的经验教训基础上,门捷列夫全面考虑了元素的各种性质,制作了63张卡片,把各个元素的名称、原子量、氧化物及物理、化学性质都分别写在各自的卡片上,根据元素的原子量,且考虑元素性质之间的联系进行排列。1869年2月,门捷列夫按原子量递增的顺序把63种元素排成几列,同时把各列中性质相似的元素左右对齐,当按原子量顺序安排的位置与元素的特征发生冲突时,他遵从元素的特征而掉换位置,或者留下空位,这样整个元素系列呈现出周期性变化。根据这一研究,他撰写了论文《根据元素的原子量和化学性质相似性的元素系统的尝试》寄给了俄国和欧洲的一些同行,在文中提出了化学元素周期律。在同年3月召开的俄罗斯化学协会的会议上,门捷列夫因病无法到会,于是委托朋友在会上宣读他的论文《元素性质与原子量的关系》,再次陈述了化学元素周期律,同时公布了他的第一张化学元素周期表。
同时,1868年德国化学家迈尔所绘制的“原子体积周期性图解”,揭示出化学元素的原子量和原子体积间关系。1869年10月,迈尔修改了他于1864年和1868年发表的元素体积,同时制作了一张化学元素周期表,表中不但明确按原子量递增的顺序来排列元素,还留下一些空格表示未知元素。虽然迈尔的研究测重于元素的物理性质,但是已明确指出元素性质是它们原子量的函数。
随后,门捷列夫汲取了迈尔周期表的长处,对周期表继续进行深入研究,于1871年重新制定出新的周期表,这个新表在许多方面都超过了迈尔的工作。其内容可概括为:元素按照原子量的大小排列,呈现出明显的性质上的周期性;原子量的大小决定元素的性质,性质相似元素的原子量或者大致相同,或者呈有规律的递增;元素原子量可以根据元素位置来修正,还可以预知一些未发现的元素。

门捷列夫
名称与符号
编辑元素英文命名
在已命名的一百多种元素中,元素名称的由来多种多样。大多数元素的名称都有一定的含意:有的是为了纪念某位科学家或元素发现的地点或国家,有的是表示元素的某一特征,还有的与星球,甚至神话传说有关。由于古希腊、古罗马是世界文明的重要发源地,所以很多元素的英文名称都来源于希腊文或拉丁文。
与人名、地名、国名有关:与人名有关的元素很多,例如einsteinium(Es,锿)、fermium(Fm,镄)等。这些词的词干都取自于著名科学家的姓氏,如A Einstein(爱因斯坦)、E.Fermi(费米)等,为了纪念他们。用来命名元素的地名,有的是矿石产地,有的是发现者的出生地或工作地,如copper(Cu,铜),出自Cuprum(拉丁文,塞浦路斯,向罗马供应金属铜的岛屿)。用国名命名的元素,如germaniun(Ge,锗)是用来纪念元素发现者的祖国德国(拉丁文Germania)的。
与物质的性质、存在或来源有关:元素的英文名也可能与元素的存在或来源矿石有关。例如,hydrogen(H,氢)、nitrogen(N,氮)等分别由希腊文的hydro(水)、nitre(硝石)与gen组合而来,表示它们分别是水之源、硝之源等。carbon(C,碳)、calcium(Ca,钙)分别由拉丁文carbo、calx派生而来,意为木炭、石灰等。元素名称还可与物质的性质有关,包括与颜色有关,例如chlorine(Cl,氯)、iodine(I,碘)分别取自希腊文chloros(黄绿色)、iodes(紫色)。与气味有关,如bromine(Br,溴)取自希腊文bromos(恶臭)。与磁性有关,如manganese(Mn,锰)取自拉丁文中的magnes(磁)。与放射性有关,如radium(Ra,镭)取自拉丁文radius(射线)。与化学性质有关,如phoSPhorus(P,磷)取自希腊文 phosphorous(光的携带者)。
与星体、神话有关:元素的命名甚至还与星体、神话有关,如uranium(U,铀)、neptunium(Np,镎)、plutonium(Pu,钚)分别出自天王星(Uranus)、海王星(Neptune)和冥王星(Pluto),因为这3种元素在周期表中的位置如同太阳系中的天王星、海王星和冥王星一样,相互紧挨着。以希腊神话中的英雄和神灵来命名的,如promethium(Pm,钷)来自希腊神话中从天上偷取火种献给人类的英雄普罗米修斯(Prometheus),比喻从原子反应堆产物里得到的钷,标志着人类进入原子时代。
对于新元素的命名,是根据国际纯粹与应用化学联合会(IUPAC)制定的非常严格的命名规则,新化学元素所选择的名字往往是为了纪念一个地点或者一个人。比如,第113号元素被命名为Nh,是日语中“日本”(Nihon)的缩写;第115号元素Mc的名字来源于莫斯科(Moscow);第117号元素Ts的名字来源于田纳西州(Tennessine),也就是著名的橡树岭国家实验室所在地。
元素名称中词尾所表示的意义:以-gen结尾的词,大多表示气态非金属元素,例如H(hydrogen)、O(oxygen)等;以-on结尾的词,大多表示固态非金属或惰性气体元素,例如B(boron)、C(carbon)等;以-ine结尾的词,大多表示卤素元素,例如 F(fluorine)、CI(chlorine)等;以-ium或-um结尾的词,大多表示金属元素,例如Li(lithium)、Na(sodium)等。
元素中文命名
化学元素除了一部分是旧有汉字外,许多是新创字,一般以谐声为主,会意次之。化学元素的名词采用一个字。其中金属元素中除汞是液体,其余是固体,它们的名词用“金”旁。例如:铜、银、金、汞为旧有名词,新创名词有钠、钾、钙、铝等。非金属元素中有的是气体,它们的名词用“气”头。有的是液体,用“氵”旁。有的是固体,它们的名词用“石”旁。例如:旧有名词有硫,新创名词包括碳、磷等。
元素命名在特殊情况下,不得不造字时,须十分谨慎。如新元素的命名,须经过广泛的讨论和深入的研究,向国家语委进行申报,使之纳入规范用字。
以新元素命名来说,选字或者造字时需要注意:能不造字就不造字,尽量选用已有的字,不得不造时,依据有关原则和方法造新字;选用汉字应遵循有关规范,或起用旧字,或类推简化;造字应遵循汉字规律;选字或造字要符合以形声字为主体的汉字书写特点,以体现元素的性质,发音靠近国际命名;选字或造字避免与以前的元素名称同音,避免用多音字;为了避免歧义,选用汉字应尽量避开生活常用字和其他行业专用字;选字或造字最好是繁简无差别的字,以利于海峡两岸和汉语文化圈科技名词的统一,如果被造字是繁体字,应类推简化。
通用的化学符号
1860年,在德国卡尔斯卢召开的第一次化学家国际会议上,各国化学家共同制订了世界统一的化学符号。这些符号,一直沿用到至今。卡尔斯卢会议决议规定,化学元素的符号,用该元素的拉丁文开头字母大写表示,有的化学元素的拉丁文开头字母相同时,就在开头字母后边以小写写上该元素拉丁文名称的第二个字母,以示区别。还有的元素的拉丁文名称的第一、第二个字母均相同时,卡尔斯卢决议规定,就用该元素拉丁文名称的第三个字母作小写字母。这种方法称为“一大二小的原则”。
分类
编辑化学元素是构成万物的基本单元。元素可分为金属元素和非金属元素两大类,其分界线为从ⅢA 族的B(硼)到ⅥA族的Te(碲)的台阶形对角线,可将其称为金属分界线。台阶形对角线左侧的元素(除氢外)为金属元素;台阶形对角线右侧的元素(加上氢)为非金属元素。
 金属与非金属分界线
金属与非金属分界线
金属是金属元素组成的一类物质。常将金属分为黑色金属和有色金属两大类,黑色金属为铁、铬、锰三种金属,其余金属为有色金属。根据有色金属的密度、储量发现和应用时间及其价值等因素,将有色金属分为五类:重有色金属、轻有色金属、稀有金属、贵金属和半金属。
此外,元素又可分为普通元素和稀有元素。其中,稀有元素一般指自然界中含量少或分布稀散,或是被人们发现得较晚,或是难从矿物中提取的,或在工业上制备和应用较晚的元素。而普通元素主要是指元素周期表中前四周期的除Li、Be和稀有气体元素以外的元素。
根据元素的生物效应,化学元素还可以分为具有生物活性的生命元素和非生命元素。在生命体内,已经发现了60多种与生命有关的元素,这些元素在生命体内含量千差万别,其作用各不一样。现代生物学和医学研究认为,这些元素按照其生物效应的不同,又可分为必需元素、有毒元素、有益元素和不确定元素四类。
起源与分布
编辑在宇宙的起源演化中,各种核素是从基本粒子经不同系列的核反应过程逐次生成的。按发生时间的先后顺序大致可分为大爆炸核合成、恒星核合成、爆发性核合成三个主要阶段,以及宇宙线散裂反应核合成。
宇宙中的元素起源的过程:宇宙大爆炸后生成了最轻的元素氢、氦以及微量的较重元素;恒星内部的核燃烧可以生成氦以及从碳到铁的多种元素;锂、铍、硼生成于宇宙线高能粒子与星际物质的散裂反应;比铁重的元素生成于小到中等质量恒星内的s过程,以及大质量恒星内的r过程和rp过程。
大部分氢云收缩形成恒星时,少量的氢云因万有引力而聚集,同时受到超新星爆发时抛射出来的重元素尘埃的污染。当这些被污染的氢云开始聚集成行星时,元素就会开始分离,重元素由于引力大,先聚集在中心,轻元素由于引力小,反而逃脱而四散,不会产生高温,因此原子就有机会形成分子,分子又聚集成固体和液体,表面则附有薄薄的一层气体,形成地球。
元素在地壳中的含量称为丰度,通常以质量分数或原子分数值表示。地球上分布最广的10种元素如下表所示。由表可见,以上10种元素约占地壳中原子总数的99%,其余所有元素的含量累计不超过1%。除了地壳,海水和大气也蕴含大量元素。
地球上分布最广的10种元素质量分数
|
元素符号 |
O |
H |
Si |
Al |
Na |
Fe |
Ca |
Mg |
K |
Ti |
|
质量分数% |
52.32 |
16.95 |
16.67 |
5.53 |
1.95 |
1.50 |
1.48 |
1.39 |
1.08 |
0.22 |
相关概念
编辑原子
原子是组成单质和化合物分子的最小微粒,也是元素的最小物质单位。在化学反应里,分子可分成原子,而原子却不能再分为更微小的粒子。
原子是由位于原子中心的带正电的原子核和核外带负电的电子构成的。其中,原子核是由中子和质子两种微粒构成的,中子呈电中性,每个质子带1个单位正电荷。因此,原子核所带的正电荷数(简称“核电荷数”)就是核内质子的数目。
原子序数
原子序数是元素在元素周期表中的序号,标注在元素周期表中元素原子符号的上方,数值上等于原子核的质子数或中性原子的核外电子数。每种元素均与一定的原子序数相对应,如铁的原子序数为26,其原子核有26个质子,核外有26个电子。
相对原子质量
相对原子质量简称原子量。国际原子量与同位素丰度委员会1979年给“原子量”下的定义是:一种元素的相对原子质量是该元素1摩尔质量对核素6C的1摩尔质量1/12的比值。
由于1 mol任何元素都含有相同的原子数,因此,相对原子质量也就是一种元素的一个原子的平均质量对核素6C一个原子的质量的1/12之比。由于很多元素都有同位素,因此,原子的平均质量是对一种元素的多种天然同位素来说的,它取决于天然同位素的数目及质量,也取决于它们在自然界中的丰度大小。相对原子质量用符号Ar(E)表示,A代表原子质量,r表示相对,E代表某元素。例如:Ar(CI)=35.453表示元素氯的相对原子质量为35.453。
同位素
同位素是指原子序数(核内质子数)相同,但质量数不同(中子数不同)的一类核素。因其原子序数相同,在元素周期表中占据同一位置而得名。同一种元素的所有组成核素相互为同位素,非特指情况下,同位素是该元素代表性稳定元素外的其他同类核素的总称。其中部分核素不稳定,称为放射性同位素。
同素异形体
同素异形体是指由同种元素组成但性质不同的单质。例如氧与臭氧、黄磷与红磷等。有三种形成方式:组成分子的原子数目不同,如O2与 O3;晶格中原子排列方式不同,如金刚石与石墨;晶格中分子排列方式不同,如斜方晶硫和单斜晶硫。这种现象称为同素异形现象。
原子半径
原子半径一般是指形成共价键或金属键时原子间接触所显示的半径。原子半径分为三种:同种元素以共价单键结合,其核间距的一半称为共价半径;在金属晶体中相邻的两个原子核间距的一半,叫该原子的金属半径;在分子晶体中,相邻两个原子核间距的一半,叫该原子的范德华半径。

共价半径和金属半径
元素周期表
编辑周期
元素周期表有7个横行,也就是7个周期。具有相同的电子层数而又按照原子序数递增顺序排列的一系列元素,称为一个周期。周期的序数就是该周期元素原子具有的电子层数。每一周期都是从碱金属开始,以稀有气体元素结束,呈现周期性变化。
各周期元素的数目不一定相同。第一周期里只有2种元素,第二、三周期里各有8种元素。第一、二、三周期都属于短周期。第四、五周期里各有18种元素,第六周期里有32种元素。第四、五、六周期属于长周期。第七周期也已全部填满。
从第六周期中的57号元素到71号元素,共15种元素,它们的电子层结构和性质非常相似,总称镧系元素。第七周期中也有一组类似的锕系元素。为了使周期表的结构紧凑,将它们按原子序数递增顺序分列两行排在周期表的下方。
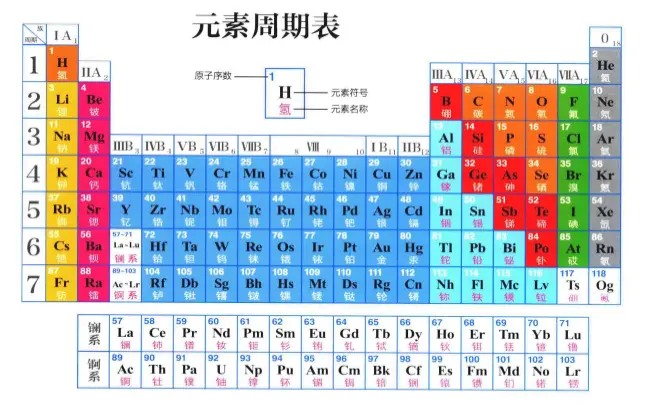
族
周期表有18个纵行,除第八、九、十3个纵行统称为Ⅷ族元素外,其余15个纵行,每个纵行标作一族,共16个族。族有主族和副族之分。由短周期元素和长周期元素共同构成的族,称为主族,用ⅠA、ⅡA、ⅢA等表示;完全由长周期元素构成的族,称为副族,用ⅠB、ⅡB、ⅢB表示。稀有气体元素的化学性质很不活泼,在通常状况下难以与其他物质发生化学反应,把它们的化合价看作为0,因而第18纵行称为0族。
元素周期表的中部从ⅢB族到ⅡB族10个纵行,包括了全部副族元素,共60多种元素,统称为过渡元素。这些元素都是金属,所以又把它们称为过渡金属。
区
根据原子的电子层结构的特征,可以把周期表中的元素所在的位置分为五个区:s区元素包括ⅠA、ⅡA族元素;p区元素从第ⅢA族到第0族元素;d区元素从第ⅢB族到第Ⅷ族元素;ds区元素包括第ⅠB、ⅡB族;f区元素包括镧系和锕系元素。
元素周期性
编辑元素的性质决定于原子的结构。由于原子的电子层结构呈现周期性变化,因此元素原子的一些基本性质,如原子半径、电离能、电子亲合能、电负性等也随之呈现明显的周期性递变规律。
原子半径
原子半径的大小主要决定于原子的有效核电荷和核外电子层数。
在元素周期表中,同周期元素的原子半径,短周期元素的原子半径随着原子序数的增加而逐渐减小。这是因为同周期元素电子层数相同,随着原子序数的增加,核电荷和有效核电荷逐渐增加,核对电子的吸引力逐渐增大,因而半径是逐渐减小的。每一周期末尾的稀有气体原子半径都特别大,这是由于稀有气体原子并没有形成化学键,其原子半径不是共价半径,而是范德华半径。
长周期的原子半径随着原子序数的增加而减小缓慢,到了ds区,原子半径反而略为增大,但随即又逐渐减小。这是因为在长周期的过渡元素的原子中,有效核电荷增大不多,因而原子半径减小缓慢。但到了长周期的后半部,即ⅠB开始,由于次外层电子全充满,增加的电子要填充在最外层,半径略为增大。当电子继续填入最外层时,因有效核电荷的增加,原子半径又逐渐减小。
镧系元素从左到右原子半径大体是逐渐减小的,且减小的幅度更小。这是因为增加的电子要填入倒数第三层(n-2)f轨道上,由于f电子对外层电子的屏蔽作用更大,使得有效核电荷增加得更小,因此半径减小得幅度更加缓慢。镧系元素整个系列原子半径缩小不明显的现象称为镧系收缩。
同主族元素的原子半径从上而下一般是增大的。这是因为从上而下电子层数是增加的,尽管核电荷也是增加的,但由于内层电子对外层电子的屏蔽作用,有效核电荷增加使半径缩小的作用不如因电子层增加而使半径增大所起的作用大,故总的结果就是原子半径由上至下加大。
同一副族元素,由上至下半径增大的幅度较小,特别是第五周期、第六周期的同族元素原子半径很相近,这就是镧系收缩效应造成的。
电离能
基态气体原子失去第一个电子成为气态+1价离子时所需的最低能量称为第一电离能,用I1表示;气态+1价离子失去第二个电子成为气态+2价离子所需要的能量称为第二电离能,用I2表示。依此类推。电离能的数值主要取决于原子有效核电荷数、原子半径和电子构型。元素的第一电离能最重要,是衡量元素原子失去电子的能力和元素金属性的一种尺度。
同一周期中,从左到右随着原子序数的增加,核电荷数逐渐增加,原子半径逐淘减小,原子核对外层电子的引力越来越大,元素原子更加不容易失去电子,因此主族元素的第一电离能从左到右逐渐增大。
但同一周期中,第一电离能的变化不像原子半径变化的那样规律,当元素的价层电子处于全空、半充满或全充满状态时,其稳定性偏高,不容易失去电子,因此其第一电离能也偏高。而同一周期过渡元素,随着原子序数的增加,电子填充到屏蔽作用较大的内层,抵消了核电荷增加所产生的影响,因此元素的第一电离能变化不大。
同一族元素,从上往下原子半径增大起主要作用,半径越大,核对电子的引力越小,越易失去电子,电离能越小。
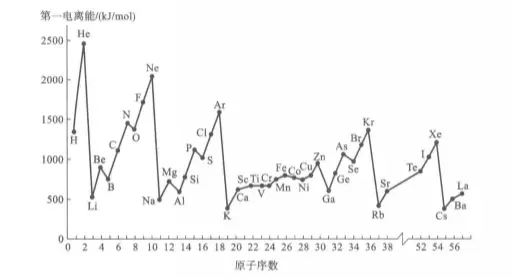
第一电离能周期性变化
电子亲和能
当气态的基态原子得到一个电子形成-1价气态负离子时,所放出的能量称为该元素的第一电子亲和能,用A1表示。由-1价气态负离子得到一个电子成为-2价气态负离子时所放出的能量称为第二电子亲和能,用A2表示,依此类推。元素的电子亲和能越大,表示原子得到电子的倾向越大,其非金属性也越强。
一般来说,同一周期从左至右,电子亲和能基本上呈现增大的趋势;同一族从上到下,电子亲和能呈现减小的趋势。但每一族开头的第一个元素的电子亲和能并非为最大,如第二周期的F、O、N 比第三周期的CI、S、P元素原子的电子亲和能要小,这是因为F、O、N的原子半径特别小,电子云密度大,电子间有强烈的排斥作用,因此要结合一个电子时放出的能量较小,电子亲和能小。电子亲和能难以直接测定,数据的完整性远不如电离能重要。
电负性
电负性是指元素的原子在分子中吸引成键电子能力的相对大小,用符号Χ来表示。电负性大,原子在分子中吸引成键电子的能力强,反之就弱。根据电负性的大小,可以衡量元素的金属性和非金属性。一般认为Χ>2的元素多为非金属元素,元素的电负性越大,生成阴离子的倾向越大,非金属性越强。Χ<2的元素多为金属元素,电负性越小,元素原子越倾向于失去电子生成阳离子,金属性越强。
电负性的周期性变化与元素的金属性、非金属性的周期性变化基本一致。即同一周期中从左到右元素的电负性依次增大;同族中自上而下元素的电负性逐渐减小(副族元素规律不明显)。在所有元素中,周期表右上方的F的电负性最大,其次是 O、CI、N,它们都具有很强的非金属性。除放射性元素外,周期表左下方的Cs的电负性最小,金属性最强。
常见元素
编辑碱金属
碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素,由于它们的氢氧化物都是易溶于水的强碱,所以统称为碱金属。碱金属元素原子的价电子结构为ns,只有一个价电子,在化学反应中很容易失去这个电子而变成稳定的+1价阳离子,因此,碱金属是典型的活泼金属。
碱金属都是银白色的金属,具有一般金属的通性,如有金属光泽,有延展性、导电性、导热性等。此外,它们还有三种特性:密度小,是典型的轻金属;硬度小,能用刀割;熔点、沸点低,其中铯的熔点最低,只有280 K,人体的温度即可使其熔化。且随着核电荷数的增加,碱金属的熔点、沸点、硬度都呈现由高到低的变化,密度则略有增大。

金属钠
碱金属元素由于最外层只有一个电子,在化学反应中很容易失去这个电子而形成+1价的阳离子,因此,碱金属都具有很强的化学活泼性,能与绝大多数非金属、水、酸等反应,是很强的还原剂。但是,随着核电荷数的增大,碱金属核外的电子层数依次增加,原子半径依次增大,失去最外层电子的倾向也依次增大,因此,碱金属的还原性顺序为:Li<Na<K<Rb<Cs<Fr。
碱金属元素的原子结构及单质的物理性质
|
元素名称 |
锂 |
钠 |
钾 |
铷 |
铯 |
|
元素符号 |
Li |
Na |
K |
Rb |
Cs |
|
核电荷数 |
3 |
11 |
19 |
37 |
55 |
|
化合价 |
+1 |
+1 |
+1 |
+1 |
+1 |
|
密度/g·cm |
0.535 |
0.971 |
0.862 |
1.532 |
1.873 |
|
熔点/K |
453.54 |
370.81 |
336.65 |
311.89 |
301.4 |
|
沸点/K |
1615 |
1155.9 |
1032.9 |
959 |
942.3 |
|
硬度 |
0.6 |
0.5 |
0.4 |
0.3 |
0.2 |
|
颜色和状态 |
银白色,质软 |
银白色,质软 |
银白色,质软 |
银白色,质软 |
银白色,质软 |
碱土金属
碱土金属元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)六种元素。碱土金属原子的价电子结构为ns,由于它们的次外层电子都已达到稳定结构,所以在化学反应中容易失去最外层的两个电子而显+2价。

金属钙
碱土金属与同周期的碱金属原子相比多了一个核电荷,原子核对电子的吸引力要强些,因此,其原子半径要小一些,金属性比碱金属弱一些。但从整个周期来看仍是活泼性相当强的金属元素。随着原子序数的增大,碱土金属的电子层依次增加,原子半径依次增大,化学活泼性依次增强。碱士金属的主要物理性质为:
碱土金属元素的原子结构及单质的物理性质
|
元素名称 |
铍 |
镁 |
钙 |
锶 |
钡 |
|
元素符号 |
Be |
Mg |
Ca |
Sr |
Ba |
|
核电荷数 |
4 |
12 |
20 |
38 |
56 |
|
化合价 |
+2 |
+2 |
+2 |
+2 |
+2 |
|
密度/g·cm |
1.848 |
1.738 |
1.55 |
2.54 |
3.5 |
|
熔点/K |
1551 |
921.8 |
1112 |
1042 |
998 |
|
沸点/K |
3243 |
1363 |
1757 |
1657 |
1913 |
|
硬度 |
4 |
2.5 |
2 |
1.8 |
– |
|
颜色 |
银白色 |
银白色 |
银白色 |
银白色 |
银白色 |
碳族元素
碳族元素位于周期系第ⅣA族,包括碳、硅、锗、锡、铅5种元素。在地壳中硅的丰度为27.6%,其含量仅次于氧;碳的丰度为 0.1%,在自然界中,碳和硅的分布都很广。锗、锡和铅的自然分布较为集中,易于提炼,应用广泛。

铅
在碳族元素中,碳和硅为非金属元素,锗、锡、铅为金属元素。但是,硅具有某些金属性,锗具有某些非金属性,这样的元素称为准金属。碳族元素的一般性质:
碳族元素的一般性质
|
元素名称 |
碳 |
硅 |
锗 |
锡 |
铅 |
|
原子序数 |
6 |
14 |
32 |
50 |
82 |
|
元素符号 |
C |
Si |
Ge |
Sn |
Pb |
|
价层电子构型 |
2s2p |
3s3p |
4s4p |
5s5p |
6s6p |
|
共价半径/pm |
77 |
117 |
122 |
141 |
175 |
|
熔点/℃ |
3550 |
1412 |
937.3 |
232 |
327 |
|
沸点/℃ |
4329 |
3265 |
2830 |
2602 |
1749 |
|
电负性 |
2.55 |
1.90 |
2.01 |
1.96 |
2.33 |
|
氧化值 |
-4、+4 |
+4 |
+2、+4 |
+2、+4 |
+2、+4 |
碳族元素的特征价电子构型为nsnp,因此,其特征氧化值为+4、+2,碳也可以有-4氧化值,且该族元素的化合物以共价型为主。位于第二周期的碳在形成化合物时,其配位数最大为4,而其他元素的配位数可以比4大,因为有nd轨道能参与成键,如GeCl6。硅与第ⅢA族的硼处于对角线位置,它们的单质及化合物的性质较为相似。在碳族元素中,从上到下,氧化值为+4的化合物的稳定性依次降低,这是惰性电子对效应的结果。例如,Pb(Ⅱ)的化合物较为稳定,而 Pb(Ⅳ)的化合物表现出较强的氧化性。
硼族元素
周期表中第ⅢA族,包括硼、铝、镓、铟、铊五种元素,通称硼族元素。硼以化合物形式存在于自然界,主要存在形式有硼砂、硼镁等。铝在地壳中的含量仅次于氧和硅,占第三位。镓、铊是分散的稀有元素,常与其他矿共生。铊及其化合物都有毒,误食少量的铊盐可使毛发脱落。

金属铝
硼族元素的价层电子构型为nsnp,最高氧化值为+3。硼是这族中唯一的非金属元素,其它都是金属元素。硼族元素的一些基本性质:
硼族元素的一般性质
|
元素名称 |
硼 |
铝 |
镓 |
铟 |
铊 |
|
原子序数 |
5 |
13 |
31 |
49 |
81 |
|
元素符号 |
B |
Al |
Ga |
In |
Tl |
|
价层电子构型 |
2s2p |
3s3p |
4s4p |
5s5p |
6s6p |
|
共价半径/pm |
88 |
126 |
135 |
167 |
176 |
|
原子量 |
10.81 |
26.98 |
69.72 |
114.82 |
204.37 |
|
电负性 |
2.04 |
1.61 |
1.81 |
1.73 |
2.04 |
|
氧化值 |
+3 |
+3 |
+1,+3 |
+1,+3 |
+1,+3 |
在硼族元素中,随着原子序数的增加,硼族元素的金属性大体上依次增加。硼族元素原子的价电子层轨道有ns、npx、npy、npz,四个,但提供的价电子只有三个,这种价电子数少于价电子层轨道数的原子,称为“缺电子原子”。硼以形成氧化值为+3的共价型分子为特征,形成的化合物由于成键的电子对数,比稀有气体电子构型缺少一对电子,被称为“缺电子化合物”。它们有非常强的接受电子对的能力,因此这种分子能自身聚合以及和电子对给予体形成稳定的配合物等。例如BF3很容易与具有孤电子对的氨形成配合物。
氮组元素
氮族元素是周期系ⅤA族元素,包括氮、磷、砷、锑、铋五种元素,其中氮、磷为非金属元素,砷和锑属准金属或半金属元素,铋则是典型的金属元素。氮主要以单质状态存在于空气中。磷在空气中极易被氧化,在自然界均为化合态,主要以磷酸盐形式存在。砷、锑、铋有时以单质存在,但主要以硫化物矿存在于自然界。
氮族元素原子的价电子层结构为nsnp,因此可呈现从-3到+5的多种氧化值,其中主要的是-3、+3、+5。当与电负性比它们小的元素(如Li、Mg、Ca等)结合时,可形成氧化值为-3的化合物,与电负性比它们大的元素(如 Cl、O 等)结合时,可形成氧化值为+3或+5的化合物。
砷、锑、铋三个元素原子的电子层结构中分别包含了d和f亚层,又因第六周期镧系收缩的结果,使这三个元素间性质递变缓慢,以至这些元素及其化合物性质比较相近。
氮族元素的一般性质
|
元素名称 |
氮 |
磷 |
砷 |
锑 |
铋 |
|
原子序数 |
7 |
15 |
33 |
51 |
83 |
|
元素符号 |
N |
P |
As |
Sb |
Bi |
|
价层电子构型 |
2s2p |
3s3p |
4s4p |
5s5p |
6s6p |
|
原子半径/pm |
70 |
110 |
121 |
141 |
152 |
|
电负性 |
3.04 |
2.19 |
2.18 |
2.05 |
1.9 |
|
主要氧化值 |
-3、+1、+2、+3、+4、+5 |
-3、+3、+5 |
-3、+3、+5 |
+3、+5 |
-+3、+5 |
氧族元素
氧族包括氧、硫、硒、碲和钋5种元素,位于周期系第ⅥA族。前四个元素是非金属元素,钋是放射性金属元素。氧族元素的一些基本性质如下:
氧族元素的一般性质
|
元素名称 |
氧 |
硫 |
硒 |
碲 |
钋 |
|
元素符号 |
O |
S |
Se |
Te |
Po |
|
价层电子构型 |
2s2p |
3s3p |
4s4p |
5s5p |
6s6p |
|
共价半径/pm |
60 |
104 |
117 |
137 |
153 |
|
电负性 |
3.44 |
2.58 |
2.55 |
2.10 |
2.0 |
|
沸点/℃ |
-183 |
445 |
685 |
990 |
962 |
|
溶点/℃ |
-218 |
115 |
217 |
450 |
254 |
|
氧化值 |
-2、-1 |
-2、+2、+4、+6 |
-2、+2、+4、+6 |
+2、+4、+6 |
+2、+6 |
氧族元素的价电子层构型为nsnp,有较强的获得电子的趋势,因此,常见的氧化值为-2、0、+2、+4、+6。氧是本族元素中电负性最大、原子半径最小、电离能最大的元素,所以,只在与氟化合时,其氧化值为正值,在其他的化合物中氧的氧化值均为负值。
卤族元素
周期表中的ⅦA族元素,包括氟、氯、溴、碘和砹等五种元素,通称为卤族元素。卤素一词的希腊原文的意思为“成盐元素”,它们都能直接和金属化合生成盐类。砹是人工合成的放射性元素。
卤素仅缺少一个电子就达到8电子的稳定结构,因此它们容易获得一个电子成为一价负离子。和同周期元素相比,卤素的非金属性是最强的。非金属性从氟到碘依次减弱。此外,卤素的熔沸点、原子半径、离子半径等都随原子序数增大而增大,而电负性随原子序数增大而减小。卤素同时也是非常活泼的非金属,能和活泼金属生成离子化合物,几乎能和所有的非金属反应,生成共价化合物。卤素在化合物中常见的氧化数为-1。除氟以外,卤素还可以形成正的氧化数。
卤素的一般性质
|
元素名称 |
氟 |
氯 |
溴 |
碘 |
|
原子序数 |
9 |
17 |
35 |
53 |
|
原子半径/pm |
67 |
99 |
114 |
138 |
|
电负性 |
3.98 |
3.16 |
2.96 |
2.66 |
|
沸点/℃ |
-188.2 |
-34.03 |
58.75 |
184.34 |
|
溶点/℃ |
-219.7 |
-100.99 |
-7.3 |
113.5 |
|
主要氧化值 |
-1 |
-1、+1、+3、+5、+7 |
-1、+1、+3、+5、+7 |
-1、+1、+3、+5、+7 |
d区元素
d区元素价层电子结构为(n-1)dns(Pd,4d5s例外)。由于(n-1)d轨道和ns轨道能量相近,d电子也可部分或全部参与成键,因此d区元素的价层电子为最外层ns和次外层(n-1)d电子。
d区元素的最后一个电子填充在次外层,因而屏蔽作用较大,有效核电荷数增加也不多,性质变化规律不同于主族元素,表现出同周期性质比较接近,从左至右随d电子数的增加而缓慢变化,呈现出一定的水平相似性。这种结构上的共同特点使过渡元素在基本性质上有许多共同之处,同时也决定了它们的性质与主族元素性质的差异性。
同周期中d区元素的原子半径变化有一定的规律性,自左向右随着原子序数的递增,原子半径缓慢减小。同族中,由于自上而下原子的电子层数逐渐增多,原子半径总趋势是增大的但因镧系收缩的影响,同族中第五、六周期两元素的原子半径非常接近。过渡元素的金属性变化规律基本是从左到右、从上到下缓慢减弱。
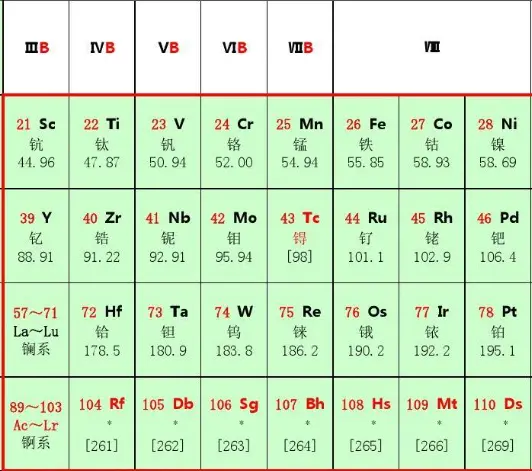
元素周期表中的d区元素
ds区元素
ds区元素是指ⅠB、ⅡB两族元素,包括铜族元素的铜、银、金和锌族元素的锌、镉、汞,该区元素处于d区和p区之间,所以性质特别。
铜族元素和锌族元素价层电子结构分别为(n-1)dns和(n-1)dns,原子结构特征是(n-1)d轨道全充满,ns轨道上有1~2个电子。由于次外层电子为18电子构型,对原子核的屏蔽效应小,因此铜族和锌族元素原子作用在最外层电子上的有效核电荷较大,所以与具有同样最外层电子结构的碱金属和碱土金属元素相比,其原子半径小,电离能高、电负性大。
铜族元素的氧化值有+1、+2和+3,这是由于铜族元素原子的最外层电子的能量与次外层d电子的能量相差较小,在反应中不仅能失去电子,在一定条件下还可以失去一个或两个次外层的d电子。锌族元素的特征氧化值为+2,但镉和汞有+1的氧化值。
ds区元素单质具有特征颜色,如铜呈紫色,银为白色,金是黄色等。由于(n-1)d电子为全充满的稳定状态,不参与成键,单质内金属键比较弱,因此,与d区元素相比,ds区元素的熔、沸点较低,其中汞是常温下唯一的液体金属。另外,ds区元素大多具有良好的导电性、导热性和延展性。其中银的导电性最好;金的延展性最好。

金属金
铜族元素的原子半径小,ns电子的活泼性远小于碱金属,因此铜、银和金单质的化学性质比较稳定,且稳定性按铜、银、金的顺序递增。锌和镉的化学性质相似,而汞的化学活泼性差得多。
参考资料
编辑展开[1]田嘉禾. 中华医学百科全书 核医学[M]. 北京: 中国协和医科大学出版社, 2020: 3-4. (2)
[2]田景春, 张翔编著. 沉积地球化学[M]. 北京: 地质出版社, 2016: 5.
[3]贾欣欣, 任丽萍主编. 无机及分析化学[M]. 北京: 中国建材工业出版社, 2005: 95.
[4]李振林, 岳延陆, 肖娜编. 《化学》学习指导书[M]. 北京: 高等教育出版社, 1991: 43.
[5]李世丰著. 原子参数与元素性质[M]. 长沙: 湖南科学技术出版社, 1982: 1.
[6]朱艳主编. 材料化学[M]. 西安: 西北工业大学出版社, 2018: 10-11.
[7]杜卫民, 朱琳编. 材料化学简明教程[M]. 长春: 吉林大学出版社, 2022: 9.
[8]李改仙等编著. 无机化学导论[M]. 北京: 中国石化出版社, 2005: 7-8.
[9]孟昭, 杨庆浩, 耿若愚编. 普通高等教育十四五规划教材 现代表面镀覆科学与技术基础[M]. 北京: 冶金工业出版社, 2022: 171.
[10]吴敏著. 化学观念教育[M]. 上海: 上海教育出版社, 2020: 45-46.
[11]那仁格日乐著. 通过热与温度的分析理解分子集合[M]. 北京: 北京邮电大学出版社, 2018: 24-25,27-28. (4)
[12]张德生, 徐汪华编著. 化学史简明教程 第2版[M]. 合肥: 中国科学技术大学出版社, 2017: 11-13,36-37. (2)
[13]范育茂著. 核反应堆安全演化简史[M]. 北京: 原子能出版社, 2016: 3.
[14]吴守玉, 高兴华, 李华隆, 黎加厚. 化学史图册[M]. 北京: 高等教育出版社, 1993: 49.
[15]吴敏著. 化学观念教育[M]. 上海: 上海教育出版社, 2020: 48.
[16]王伟群, 陆真编. 简明化学史[M]. 上海: 上海教育出版社, 2021: 98,105-107. (4)
[17]叶永烈著. 叶永烈讲元素的故事[M]. 武汉: 长江文艺出版社, 2020: 14-17. (4)
[18]周嘉华, 李华隆著. 大众化学化工史[M]. 济南: 山东科学技术出版社, 2015: 62-65.
[19]张文广编著. 无机化学—专题教学研究[M]. 上海: 复旦大学出版社, 2019: 133-136. (4)
[20](法)大卫·卢阿普尔作, 孙佳雯译, (法)利松·贝尔内绘画. 全世界科学家想破脑袋也想不明白的科学谜题[M]. 2022: 10-11.
[21]王箴编著. 化工基础[M]. 燃料化学工业出版社, 1973: 83.
[22]王琪作. 汉语术语规范化理论与实践[M]. 北京: 商务印书馆, 2022: 76-77. (2)
[23]张菊芳著. 化学-我们的生活和未来[M]. 太原: 山西人民出版社, 2014: 54-55. (2)
[24]石建屏主编. 应用化学[M]. 武汉: 武汉理工大学出版社, 2003: 4.
[25]黄礼煌著. 贵金属提取新技术[M]. 北京: 冶金工业出版社, 2016: 353-354.
[26](英)北方旅行出版公司编, 杨瑞洋译. 你好,科学! 探索化学[M]. 青岛: 青岛出版社, 2020: 6.
[27]贾之慎主编. 无机及分析化学 第2版[M]. 北京: 中国农业大学出版社, 2014: 331.
[28]孙扬, 胡中为编. 天文学教程 下[M]. 上海: 上海交通大学出版社, 2020: 345-346. (2)
[29]朱万森著. 生命中的化学元素[M]. 上海: 复旦大学出版社, 2014: 23.
[30]盘鹏慧, 容学德, 杨柳青主编. 普通化学[M]. 北京: 北京理工大学出版社, 2020: 16-17. (2)
[31]吴胜富主编. 普通化学[M]. 北京: 北京理工大学出版社, 2017: 15-16. (2)
[32]赵克健主编. 现代药学名词手册[M]. 北京: 中国医药科技出版社, 2004: 207.
[33]刘霞主编. 大学化学[M]. 北京: 中国农业大学出版社, 2007: 19-22,25. (3)
[34]刘丹赤主编, 于园, 周鸿燕副主编. 中国轻工业“十三五”规划教材 基础化学 第2版[M]. 北京: 中国轻工业出版社, 2019: 2-3. (2)
[35]衷友泉, 孙立平主编. 无机化学[M]. 武汉: 华中科技大学出版社, 2020: 212-216. (5)
[36]李涛, 邱于兵主编. 工程化学基础[M]. 武汉: 华中科技大学出版社, 2021: 24.
[37]盖媛媛, 任金艳, 刘瑞玲著. 基础化学与化工分析[M]. 长春: 吉林科学技术出版社, 2021: 5,9.
[38]岳红主编. 无机化学 第2版[M]. 西安: 西北工业大学出版社, 2022: 349.
[39]杨怀霞, 刘幸平主编, 吴培云, 吴巧凤, 王平等副主编. 无机化学[M]. 北京: 中国医药科技出版社, 2014: 237-238.
[40]苏小云, 臧祥生编. 工科无机化学 第3版[M]. 上海: 华东理工大学出版社, 2004: 342-343.
[41]岳红主编. 无机化学[M]. 西安: 西北工业大学出版社, 2015: 358.
[42]刘丹赤主编, 于园, 周鸿燕副主编. 中国轻工业“十三五”规划教材 基础化学 第2版[M]. 北京: 中国轻工业出版社, 2019: 147-148. (2)
[43]衷友泉, 孙立平主编. 无机化学[M]. 武汉: 华中科技大学出版社, 2020: 207.
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/428039/
