氯化氢(英文名:Hydrogen Chloride)又称无水盐酸,是一种由氢原子和氯原子构成的无机化合物。化学式为HCl,摩尔质量为36.46g/mol,密度为1.6392g/cm(0℃条件下)。其常温下为无色有刺激性气味的气体,易溶于水,形成盐酸。氯化氢在干燥状态下几乎不与金属作用,但溶于水形成酸性和腐蚀性很强的盐酸后会和金属发生反应;氯化氢与碱发生中和反应生成盐类,与乙炔等不饱和烃反应生成加成物。在实验室中主要通过固体氯化钠和浓硫酸反应制取氯化氢;在工业中通过氢气在氯气中燃烧进行合成或通过烷烃氯化进行氯化氢制备。
简史
编辑在15世纪之前,古老的炼金术士曾将食盐与硫酸铁蒸馏发生的气体溶解于水中得到了盐酸。1772年,英国化学家普利斯特里(Joseph Priestley)最先捕集到氯化氢气体制得纯盐酸,并试验其性质。1791年,法国化学家勒布朗(Nicolas Leblanc)探索出了生产碳酸钠的工艺。该方法的第一步需要将氯化钠与硫酸加热制备硫酸钠,此过程产生的副产物氯化氢气体会被直接排放到空气中。1810年,英国化学家戴维(Davy)证明氯化氢为氢原子和氯原子构成的化合物。

英国化学家普利斯特里
氯化氢气体对人体有危害,主要是对鼻腔、咽喉等呼吸道粘膜的刺激作用,当浓度达1000—2000ppm时有生命危险,可急性致死。1836年,英国的化学品制造商威廉·戈萨奇(Wiliam Gossage)采用焦炭为填料的洗涤塔回收氯化氢气体,以减少其对工厂周围环境的影响。英国在1863年颁布了世界上第一个有关环境保护的碱工业法规,限令各工厂必须回收95%的氯化氢气体,并规定排出气体中氯化含量标准。那些过量的不能用于制备盐酸的氯化氢气体被氧化生成氯气,作为生产漂白粉的原料。第一次世界大战后,各国纷纷调整其工业结构,1923年英国最后一家勒布朗法盐酸工厂关闭,盐酸的生产逐渐由直接合成法取代,但因部分造纸、玻璃工业需要硫酸钠为原料,所以布朗法生产硫酸钠和氯化氢的工艺尚有少数工厂在使用,这部分氯化氢在整个氯化氢的产量中已很少。1931年,美国杜邦公司实现由电石乙炔制氯丁二烯工业生产,乙炔在氯化亚铜的酸性水溶液中生成乙烯基乙炔,后再与氯化氢在氯化亚铜的盐酸溶液中进行加成反应生成氯丁二烯。第二次世界大战后,石油化工和塑料等聚合物工业的迅速发展,氯化氢和盐酸生产的工艺构成亦起了变化。氯化氢产量的比重增大,在20世纪70年代后期,由于某些国家对氟氯烃等产品生产的限制,致使副产氯化氢产量比例有所下降,而合成氯化氢产量上升。
理化性质
编辑物理性质
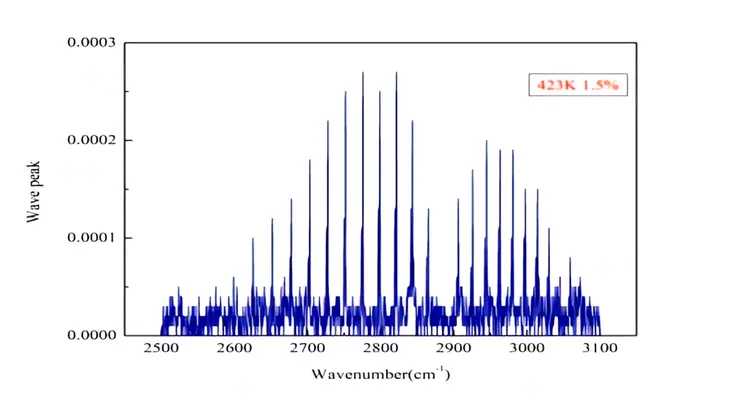
氯化氢在常温下为无色、有刺激性气味的气体,对上呼吸道有强刺激,对眼、皮肤、黏膜有腐蚀,遇潮湿的空气产生白雾。氯化氢的密度比空气大,易溶于水,在常温下,1体积的水大约能溶解450体积的氯化氢,还易溶于乙醇和醚,也能溶于其它多种有机物。氯化氢的熔点为-114.18℃,沸点为-84.9℃。氯化氢气体的红外光谱的波数范围大致在2450cm—3100cm。HCl气体有两个振动谱带,且每个振动谱带都有两个分支。在红外光谱图中,HCI的特征吸收峰表现为一个强的宽峰。
化学性质
与金属反应
盐酸与大多数的金属反应生成该金属的氯化物。干燥氯化氢的化学性质很不活泼,几乎不与金属作用,因此通常在无水的情况下不反应,形成盐酸才反应。碱金属和碱土金属在氯化氢中会发生燃烧反应,例如钠燃烧时会发出亮黄色的火焰。盐酸与金属的反应有如:铁与盐酸反应生成氯化亚铁和氢气;锌与盐酸反应生成氯化锌和氢气。
与碱反应
氯化氢可以被碱性溶液吸收,而中和成盐类,如:氯化氢与氨水反应生成氯化铵;氯化氢和氢氧化钠反应生成氯化钠和水,利用这个性质,在工业生产中常采用石灰乳处理氯化氢的酸性下水,可以除去其酸性,防止下水道被腐蚀。
与不饱和烃反应
氯化氢可以与乙炔等不饱和烃反应生成加成物,如:氯化氢和乙炔反应生成氯乙烯。
其他
氯化氢是有毒、有腐蚀性的不可燃气体,空气中常以盐酸烟雾的形式存在。由于HCl的H和Cl间的一对共有电子偏向Cl原子,所以Cl略带负电性,H略带正电性,氯化氢有强烈的偶极,与其它偶极产生氢键。氯化氢偶极矩为正负电荷重心的距离与电荷量的乘积,约为1.03D。
应用
编辑氯化氢溶于水即成盐酸。盐酸是六大无机强酸之一,用途很广,普遍用于制造各种化学药品、药物、味精及染色工业,还可用于有机化学产品生产,在经济中占有很重要的地位。
食品工业
氯化氢可用于生产食品以及食品添加剂。如用于生产蛋白纤维、豆腐、猕猴桃酱等食品,在制作酱油和味精时,盐酸具有催化作用,能促使其中复杂的蛋白质进行水解;此外,还可用于制造淀粉以及水解酒精与葡萄糖。
轻纺工业
氯化氢可用于纺织品的印染以及皮革染色、鞣[róu]革、提取骨胶等。如用于酸洗漂白后的棉布、中和棉布丝光处理后残留的碱。在印染过程中,可以使用盐酸将一些不溶于水的染料处理成可溶的盐酸盐。
冶金工业
氯化氢在钢铁、电镀工业中作为金属的腐蚀剂和表面清洁剂。如使用浓度为18%的盐酸去除钢材表面的锈或铁氧化物用于的材料预处理,方便接下来轧制钢材或给钢材镀锌等操作;此外在金属焊接之前,在焊口涂上一点盐酸,也是利用盐酸能溶解金属氧化物,使得金属表面镀或焊得更牢。
化学工业
氯化氢在无机和有机化学中有很广泛的应用。如可用于制造各种金属氯化物、合成药物、染料、皂化油脂等;氯化氢气体还可作为聚氯乙烯、氯丁橡胶、离子交换树脂等的生产原料,在180~200℃的温度并有汞盐(如HgCl)作化剂的条件下,氯化氢与乙炔聚合而成聚氯乙烯。
医药方面
在医药生产方面,盐酸它与某些金属、金属氧化物、金属氢氧化物以及大多数金属盐类都能发生反应,盐酸可被应用于药物成盐。在医药上许多药物,如奴弗卡因、盐酸硫胺等,需要用盐酸制成。此外,盐酸还可用治疗幽门梗阻、肝硬化和肾功能衰竭等并发的代谢性低氯性碱中毒病症。
水处理
盐酸是一种无机强酸,酸洗时盐酸与水垢可生成金属氯化物。可用于碳酸钙一类的水垢清洗。此外,盐酸还可以用来调节溶液的pH,如在工业中对纯度的要求极高时(如用于食品、制药及饮用水等),常用高纯的盐酸来调节水流pH;以及中和废水或处理游泳池中的水。
制备方式
编辑实验室制取
实验室一般是用固体氯化钠和浓硫酸起反应,不加热或稍微加热,生成硫酸氢钠和氯化氢。然后在500℃到600℃的条件下,继续起反应而生成氯化氢和硫酸钠。
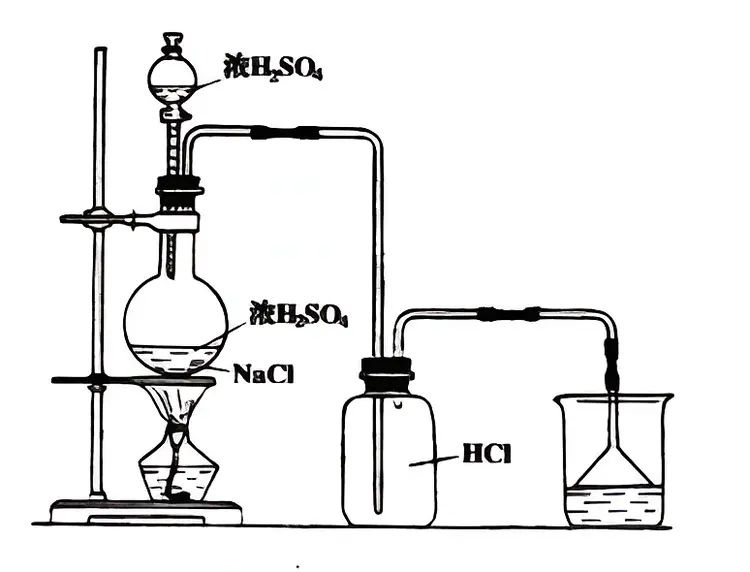
氯化氢制取装置图(向上排气法)
工业制取
工业上氯化氢的合成是在特制的合成炉中进行的,反应原理是电解食盐水后点燃产生的氢气和氯气:
为了确保产品中不含有游离氯,氢气要较氯气过量15%~20%。实际生产的炉中火焰温度在200℃左右。由于反应是一个放热反应,为了不使反应温度过高,工业生产通过控制氯气和氢气的流量,和在壁炉外夹套间通冷却水的办法控制氯化氢出炉温度小于 350℃。在生产中为确保安全生产,要求氢气纯度不小于98%和含氧不大于0.4%;氯气纯度不小于65%和含氢不大于3%。
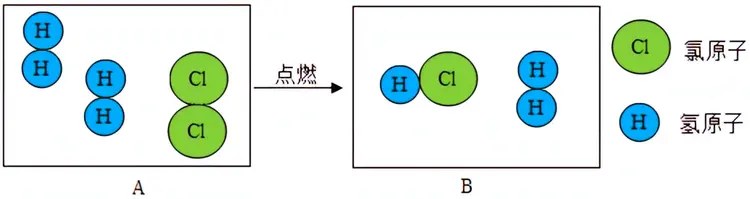
氢气在氯气中燃烧生成氯化氢
还可以通过烷烃的氯化进行氯化氢的制备,具体方法如下:烷[wán]烃的氯化反应是一种自由基反应。反应过程中,反应物的共价键发生均裂,生成自由基。一般地说自由基很不稳定,极易与其它化合物的分子发生反应,使自己变成稳定的分子,又使其它化合物的分子变为自由基,从而引起一连串反应(链反应)。例如,氯分子在光照下,均裂为氯自由基。
反应由此开始,所以这个步骤叫做链的引发。氯自由基很活泼,它夺取甲烷分子中的氢结合为氯化氢,产生甲基自由基。
物质结构
编辑氯化氢的化学式为HCl,分子结构式为H-Cl,H-Cl键为极性共价键,HCl是极性分子。氯化氢气体在-84℃液化,在-112℃凝结成固体,这种变化是物理变化,因为固体氯化氢是分子性晶体,是以分子间力而结合的。固体氯化氢的晶系以两种变体存在,分别为斜方体(在温度低于-174.75℃时稳定)和立方体。
安全事宜
编辑健康危害
气态无水氯化氢由于其水溶性高,能溶解人体任何部位的水分,因此,对眼皮肤、黏膜以及呼吸系统有刺激作用。在接触过程中,主要影响的是呼吸系统,其次是眼睛除接触少量无水氯化氢之外,都有可能造成严重的皮肤和眼睛灼伤。液态无水氯化氢是一种冷冻的压缩气体,眼睛和皮肤接触会产生严重灼伤,与冻伤类似。氯化氢还会造成急性中毒,伴随着头痛、头晕、恶心、眼痛、咳嗽、痰中带血、声音嘶哑、呼吸困难、胸闷、胸痛等症状,重者还会发生肺炎、肺水肿、肺不张。眼角膜可见溃疡或混浊。皮肤直接接触可出现大量粟粒样红色小丘疹而呈潮红痛热。此外,长期与较高浓度的氯化氢接触,可引起慢性支气管炎、胃肠功能障碍及牙齿酸蚀症。
应急处置
处理方法
如发生泄露,应急处理人员佩戴气密式化学防护服包括自给式呼吸器从上风处进入现场。人员迅速从泄漏污染区撤离至上风处,并提醒周边公众进行紧急疏散。立即对泄漏区进行隔离直至气体散尽。在确保安全的情况下,采用关阀、堵等措施,尽可能切断泄漏合理通风,加速扩散。防止气体通过通风系统扩散或进入限制性空间。喷氨水或其他稀碱液中和、稀释,构筑围堤或挖坑收容产生的废水。破损容器要由专业人员处理,修复、检验后再用。
急救措施
皮肤接触要立即脱去被污染的衣着,用大量流动清水冲洗至少15min,就医。眼睛接触应提起眼睑,用大量流动清水、生理盐水冲洗或在脸盆中将头部埋入水中作晃动清洗至少15min或更长,不允许自行试图用化学品中和,立即就医。如吸入氯化氢应迅速撤离现场至空气新鲜处,保持呼吸道通畅。保持安静,休息,半直立体位,并及时给予医疗护理。如呼吸困难,应给予输氧,必要时进行人工呼吸。如呼吸、心跳停止,应立即进行心肺复苏术并及时就医。密切接触者即使无症状,亦应观察24~48小时
环境危害
氯化氢对水和土地也可造成污染。由于氯化氢极易溶于水,因此排放到大气中的氯化氢会与空气中的水蒸气结合并生成盐酸,盐酸具有强腐蚀性,与雨水一同落入地面就形成腐蚀性比较强的酸雨,对植物、建筑物等危害很大,深入地下还可能污染地下水和土壤。
环保治理
氯化氢废气的治理主要采用吸收法,主要由中和吸收和水吸收等,其中中和吸收法是用碱液或石灰乳进行中和吸收,是一种应用较多的方法;水吸收法则是利用氯化氢是易溶于水的气体原理进行水吸收。此外,也可以采用活性炭吸附法处理氯化氢废气,而吸收装置一般采用吸收塔,文丘里吸收管等,在气体浓度较高时,采用膜式吸收塔、湍球吸收塔等;氯化氢废气吸收装置多用橡胶、聚氯乙烯或玻璃钢等作衬里,可以防腐蚀。
职业接触限值
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/1242347/
