丝氨酸蛋白酶
编辑丝氨酸蛋白酶(或丝氨酸内肽酶)是酶的是切割肽键在蛋白质,其中丝氨酸作为亲核氨基酸在(酶的)活性位点。它们普遍存在于真核生物和原核生物中。丝氨酸蛋白酶根据其结构分为两大类:胰凝乳蛋白酶样(胰蛋白酶样)或枯草杆菌蛋白酶样。
丝氨酸蛋白酶的分类
编辑在MEROPS蛋白酶分类系统16个计数超家族(如2013),每个包含许多家庭。每个超家族使用催化三联体在不同的或成对蛋白质折叠等代表趋同进化的的催化机制。大多数属于蛋白酶的PA家族(超家族)的S1家族。
对于超家族,P=超家族,包含亲核类家族的混合物,S=纯丝氨酸蛋白酶。超家族。在每个超家族中,家族由其催化亲核试剂指定(S=丝氨酸蛋白酶)。
底物特异性
编辑丝氨酸蛋白酶的特点是具有独特的结构,由两个在催化活性位点会聚的β-桶结构域组成。这些酶可以根据它们的底物特异性进一步分类为胰蛋白酶样、胰凝乳蛋白酶样或弹性蛋白酶样。
胰蛋白酶样
编辑胰蛋白酶样蛋白酶在带正电荷的氨基酸(赖氨酸或精氨酸)之后切割肽键。这种特异性是由位于酶S1口袋底部的残基驱动的(通常是带负电荷的天冬氨酸或谷氨酸)。
胰凝乳蛋白酶样
编辑胰凝乳蛋白酶样酶的S1口袋比胰蛋白酶样蛋白酶更疏水。这导致对中到大尺寸疏水残基的特异性,例如酪氨酸、苯丙氨酸和色氨酸。
类凝血酶
编辑这些包括凝血酶、组织激活型纤溶酶原和纤溶酶。已发现它们在凝血和消化以及神经退行性疾病(如阿尔茨海默氏症和帕金森氏诱发的痴呆症)的病理生理学中发挥作用。
类弹性蛋白酶
编辑弹性蛋白酶样蛋白酶的S1裂缝比胰蛋白酶或胰凝乳蛋白酶样蛋白酶小得多。因此,残基如丙氨酸、甘氨酸和缬氨酸往往是优选的。
枯草杆菌蛋白酶
编辑枯草杆菌蛋白酶是原核生物中的一种丝氨酸蛋白酶。枯草杆菌蛋白酶在进化上与胰凝乳蛋白酶家族无关,但具有相同的催化机制,利用催化三联体来产生亲核丝氨酸。这是用来说明趋同进化的经典例子,因为同一机制在进化过程中独立进化了两次。
催化机制
编辑丝氨酸蛋白酶催化机制的主要参与者是催化三联体。三联体位于酶的活性位点,在那里发生催化作用,并保存在丝氨酸蛋白酶的所有超家族中。三联体是由三个氨基酸组成的协调结构:His57、Ser195(因此得名“丝氨酸蛋白酶”)和ASP102.这三种关键氨基酸均在蛋白酶的切割能力中发挥重要作用。虽然三联体的氨基酸成员在蛋白质序列上彼此远离,但由于折叠,它们在酶的核心彼此非常接近。三元组成员的特定几何形状对其特定功能具有高度特征:表明三元组中仅四个点的位置表征了包含酶的功能。
在催化的情况下,会发生一种有序的机制,其中会生成几个中间体。肽裂解的催化可以看作是乒乓催化,其中底物结合(在这种情况下,多肽被裂解),一个产物被释放(肽的N端“一半”),另一个底物结合(在这种情况下是水),并释放另一种产物(肽的C端“一半”)。
三联体中的每个氨基酸在此过程中执行特定任务:
- 所述丝氨酸具有-OH基团,其能够充当亲核试剂,攻击羰基的碳的易断裂的基板的肽键。
- 组氨酸氮上的一对电子具有从丝氨酸-OH基团接受氢的能力,从而协调肽键的攻击。
- 在羧基上的组天冬氨酸反过来氢键与组氨酸,使氮原子上述更加电负性。
整个反应可以概括如下:
- 所述多肽底物结合到所述丝氨酸的表面蛋白酶,使得所述易断裂键被插入到酶的活性部位,与该键位于靠近的羰基碳的亲核丝氨酸。
- 所述丝氨酸-OH攻击羰基碳,和中的氮组氨酸接受从的-OH和从的双键的一对电子的氢羰基氧移动到氧。结果,生成了四面体中间体。
- 肽键中连接氮和碳的键现在被破坏了。产生这种键的共价电子移动攻击组氨酸的氢,破坏连接。先前从羰基氧双键移出的电子从负氧移回以重建键,生成酰基酶中间体。
- 现在,水进入反应。水取代裂解肽的N端,并攻击羰基碳。再一次,当水的氧和碳之间形成键时,来自双键的电子移动到氧上,使其变为负电。这是由组氨酸的氮协调,它接受来自水中的质子。总的来说,这产生了另一个四面体中间体。
- 在最后的反应中,丝氨酸和羰基碳之间在第一步中形成的键移动以攻击组氨酸刚刚获得的氢。现在缺电子的羰基碳与氧重新形成双键。结果,肽的C端现在被弹出。
额外的稳定效果
编辑发现蛋白酶的其他氨基酸Gly193和Ser195参与产生所谓的氧阴离子孔。两个甘氨酸193和丝氨酸195可以捐赠骨干氢为氢键。当生成步骤1和步骤3的四面体中间体时,负氧离子接受了来自羰基双键的电子,完全适合氧阴离子空穴。实际上,丝氨酸蛋白酶优先结合过渡态有利于整体结构,降低反应的活化能。这种“优先结合”是酶的大部分催化效率的原因。
丝氨酸蛋白酶活性的调节
编辑宿主生物必须确保丝氨酸蛋白酶的活性得到充分调节。这是通过对初始蛋白酶激活和抑制剂分泌的要求来实现的。
酶原激活
编辑酶原是酶的通常无活性的前体。如果消化酶在合成时活跃,它们会立即开始咀嚼合成器官和组织。急性胰腺炎就是这样一种情况,其中胰腺中的消化酶过早激活,导致自我消化(自溶)。它还使死后调查复杂化,因为胰腺通常会在进行肉眼评估之前自行消化。
酶原是大的、无活性的结构,能够分解或变成较小的活化酶。酶原和活化酶之间的区别在于,酶原催化的活性位点是扭曲的。结果,底物多肽不能有效结合,不发生蛋白水解。只有在激活后,酶原的构象和结构发生变化,活性位点被打开,才能发生蛋白水解。
抑制
编辑某些抑制剂类似于四面体中间体,因此会填满活性位点,阻止酶正常工作。胰蛋白酶是一种强大的消化酶,在胰腺中产生。抑制剂阻止胰腺自身的自我消化。
丝氨酸蛋白酶与丝氨酸蛋白酶抑制剂配对使用,当不再需要它们时会关闭它们的活性。
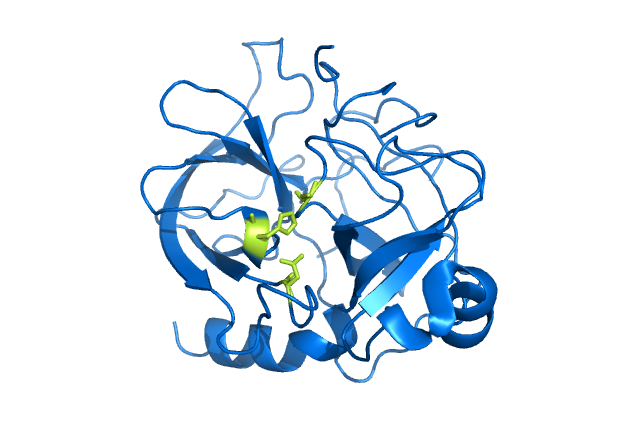
丝氨酸蛋白酶被多种抑制剂抑制,包括用于研究或治疗目的的合成化学抑制剂,以及天然蛋白质抑制剂。一类称为“丝氨酸蛋白酶抑制剂”(缩写为丝氨酸蛋白酶抑制剂)的天然抑制剂可以与丝氨酸蛋白酶形成共价键,从而抑制其功能。研究最多的丝氨酸蛋白酶抑制剂是抗凝血酶和α1-抗胰蛋白酶,分别研究了它们在凝血/血栓形成和肺气肿/A1AT中的作用。人工不可逆小分子抑制剂包括AEBSF和PMSF。
已经在蝗虫和小龙虾中发现了一个名为pacifastin的节肢动物丝氨酸肽酶抑制剂家族,并且可能在节肢动物的免疫系统中起作用。
在疾病中的作用
编辑突变可能导致酶活性降低或增加。这可能会产生不同的后果,具体取决于丝氨酸蛋白酶的正常功能。例如,蛋白C的突变会导致蛋白C缺乏和易患血栓形成。此外,一些蛋白酶通过引发病毒的Spike蛋白显示名为“融合蛋白”的蛋白质(TMPRSS2激活SARS-CoV-2融合),在宿主细胞-病毒融合激活中发挥着至关重要的作用。
诊断用途
编辑丝氨酸蛋白酶水平的测定在特定疾病的背景下可能有用。
- 在诊断出血性或血栓性病症时可能需要凝血因子水平。
- 粪便弹性蛋白酶用于确定胰腺的外分泌活性,例如在囊性纤维化或慢性胰腺炎中。
- 血清前列腺特异性抗原用于前列腺癌筛查、风险分层和治疗后监测。
- 由肥大细胞释放的丝氨酸蛋白酶是1型超敏反应(例如过敏反应)的重要诊断标志物。由于更长的半衰期,比组胺更有用,这意味着它在系统中保留临床有用的时间长度。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/127076/
