氢键
编辑氢键(或H键)是共价结合到更具电负性的供体原子或基团(Dn)的氢(H)原子与带有孤对电子的另一个电负性原子之间的主要静电吸引力-氢键受体(Ac)。这种相互作用的系统通常表示为Dn-H···Ac,其中实线表示极性共价键,点划线表示氢键。
最常见的供体和受体原子是第二排元素氮(N)、氧(O)和氟(F)。氢键可以是分子间的(发生在不同的分子之间)或分子内的(发生在同一分子的部分之间)。
氢键的能量取决于几何形状、环境以及特定供体和受体原子的性质,可以在1到40kcal/mol之间变化。这使得它们比范德华相互作用强一些,比完全共价键或离子键弱。这种类型的键可以发生在无机分子(如水)和有机分子(如DNA和蛋白质)中。
氢键负责将纸张和毡制羊毛等材料保持在一起,并导致单独的纸张在变湿并随后干燥后粘在一起。氢键是造成N、O和F化合物的许多异常物理和化学性质的原因。
特别是,与其他组相比,分子间氢键是水的高沸点(100°C)的原因-16种氢键较弱的氢化物。分子内氢键部分负责蛋白质和核酸的二级和三级结构。它还在合成和天然聚合物的结构中发挥重要作用。
氢键粘合
编辑定义和一般特征
与相对电负性原子相连的氢原子是氢键供体。只有当碳原子与电负性取代基结合时,CH键才参与氢键,如氯仿CHCl3中的情况。在氢键中,不与氢共价连接的电负性原子称为质子受体,而与氢共价结合的电负性原子称为质子供体。
虽然IUPAC推荐了这种命名法,但它可能会产生误导,因为在其他供体-受体键中,供体/受体分配是基于电子对的来源(这种命名法也被一些作者用于氢键)。在氢键供体中,H中心是质子的。捐助者是刘易斯基地。
氢键表示为H···Y系,其中的点代表氢键。氢键通常被描述为静电偶极-偶极相互作用。但是,它也具有共价键的一些特征:方向性强,产生的原子间距离小于范德华半径之和,通常涉及有限数量的相互作用伙伴,这可以解释为一种化合价。
当受体结合来自更多电负性供体的氢时,这些共价特征更加显着。作为更详细的标准列表的一部分,IUPAC出版物承认有吸引力的相互作用可能来自静电(多极-多极和多极诱导的多极相互作用)、共价(轨道重叠引起的电荷转移)和色散(伦敦力),并指出每个的相对重要性将因系统而异。
但是,该标准的脚注建议排除以色散为主要贡献者的相互作用,特别给出Ar—CH4和CH4—CH4作为此类相互作用的示例,这些相互作用应从定义中排除。
尽管如此,大多数介绍性教科书仍然将氢键的定义限制在开头段落中描述的经典类型的氢键上。与硫(S)或氯(Cl)等元素结合的氢原子已知较弱的氢键;甚至碳(C)也可以作为供体,特别是当碳或其邻居之一是带负电的(例如,在氯仿、醛和末端乙炔中)。
逐渐地,人们认识到有许多较弱的氢键的例子涉及除N、O或F以外的供体和/或受体Ac,其电负性接近氢的电负性(而不是更多的电负性)。
尽管这些非传统的氢键相互作用通常很弱(≈1kcal/mol),但它们也无处不在,并且越来越多地被认为是药物化学中受体-配体相互作用或材料科学中分子内/分子间相互作用的重要控制元素。随着时间的推移,氢键的定义逐渐扩大到包括这些较弱的吸引力相互作用。
2011年,IUPAC工作组推荐了一种基于现代证据的氢键定义,该定义发表在IUPAC期刊PureandAppliedchemistry上。该定义规定:氢键是分子或分子片段X-H中的氢原子(其中X比H更具电负性)与相同或不同分子中的一个原子或一组原子之间的有吸引力的相互作用,其中存在债券形成的证据。
粘结强度
氢键的强度可以从弱(1-2kJmol-1)到强(离子HF-2中的161.5kJmol-1)不等。蒸气中的典型焓包括:
- F-H···:F(161.5kJ/mol或38.6kcal/mol),由氟化氢HF2-唯一说明
- O-H···:N(29kJ/mol或6.9kcal/mol),图示为水-氨
- O-H···:O(21kJ/mol或5.0kcal/mol),图示水-水,酒精-酒精
- N−H···:N(13kJ/mol或3.1kcal/mol),以氨-氨为例
- N−H···:O(8kJ/mol或1.9kcal/mol),图示为水-酰胺
- OH+3···:OH2(18kJ/mol或4.3kcal/mol)
分子间氢键的强度通常通过测量含有供体和/或受体单元的分子之间的平衡来评估,最常见的是在溶液中。分子内氢键的强度可以通过具有和不具有氢键的构象异构体之间的平衡来研究。鉴定复杂分子中氢键的最重要方法是晶体学,有时还有核磁共振光谱学。
结构细节,特别是小于范德华半径之和的供体和受体之间的距离,可以作为氢键强度的指示。一种方案给出了以下有点武断的分类:15到40kcal/mol、5到15kcal/mol和>0到5kcal/mol的那些分别被认为是强、中和弱。
共振辅助氢键
共振辅助氢键(通常缩写为RAHB)是一种强类型的氢键。它的特点是涉及氢的π离域,不能单独用静电模型正确描述。已经提出这种氢键描述来描述通常在O=C-OH∙∙∙或∙∙∙O=CC=C-OH之间观察到的异常短距离。
结构细节
X-H距离通常约为110pm,而H···Y距离约为160到200pm。水中氢键的典型长度为197pm。理想的键角取决于氢键供体的性质。氢氟酸供体和各种受体之间的以下氢键角已通过实验确定:
光谱学
强氢键通过1HNMR光谱中的低场位移揭示。例如,乙酰丙酮的烯醇互变异构体中的酸质子出现在δH15.5处,这大约是常规酒精的10ppm低场。在IR光谱中,氢键将XH伸缩频率移动到较低能量(即振动频率降低)。这种转变反映了XH键的减弱。某些氢键-不正确的氢键-显示XH拉伸频率的蓝移和键长的减少。
氢键也可以通过受体的IR振动模式变化来测量。当它们与侧链羟基形成H键时,α-螺旋中骨架羰基的酰胺I模式转移到较低频率。
氢键理论考虑
氢键具有持久的理论意义。根据现代描述,O:H2O整合了分子间O:H孤对:非键和与OO排斥耦合相关的分子内H2O极性共价键。相关残基间电位常数(顺应常数)的量子化学计算揭示了同一类型的单个H键之间的巨大差异。例如,与腺嘌呤-胸腺嘧啶对之间的N-H···N键相比,鸟嘌呤和胞嘧啶之间的中心残基间N-H···N氢键要强得多。
从理论上讲,氢键的键强度可以使用NCI指数(非共价相互作用指数)评估,正如其名称所示,它允许使用系统的电子密度来可视化这些非共价相互作用。从对普通冰的康普顿剖面各向异性的解释来看,氢键部分是共价的。然而,这种解释受到了挑战。
最一般地,氢键可以被视为两个或多个分子间键之间的依赖于度量的静电标量场。这与例如共价键或离子键的分子内结合状态略有不同;然而,氢键通常仍然是一种束缚态现象,因为相互作用能具有净负和。
莱纳斯·波林 (LinuSPauling) 提出的最初的氢键理论表明氢键具有部分共价性质。这种解释一直存在争议,直到NMR技术证明了氢键原子核之间的信息转移,这一壮举只有在氢键包含一些共价特征时才有可能。
氢键的历史
编辑氢键的概念曾经具有挑战性。莱纳斯·波林 (LinusPauling) 将1912年首次提到氢键归功于TSMoore和TFWinmill。Moore和Winmill使用氢键来解释三甲基氢氧化铵比四甲基氢氧化铵弱碱这一事实。
几年后,即1920年,拉蒂默和罗德布什对氢键在其更为人所知的环境中的描述进行了描述。在那篇论文中,拉蒂默 (Latimer) 和罗德布什 (Rodebush) 引用了他们实验室的一位科学家同事莫里斯·洛亚尔·哈金斯 (MauriceLoyalHuggins) 的工作,他说,该实验室的哈金斯 (Huggins) 先生在一些尚未发表的工作中使用了两个原子之间的氢核的想法作为关于某些有机化合物的理论。
小分子中的氢键
编辑水
在水分子之间发现了一个普遍存在的氢键示例。在离散的水分子中,有两个氢原子和一个氧原子。最简单的情况是一对水分子之间有一个氢键,称为水二聚体,通常用作模型系统。当存在更多分子时,就像液态水一样,可能会有更多的键,因为一个水分子的氧有两个孤对电子,每个电子对都可以与另一个水分子上的氢形成氢键。这可以重复,使得每个水分子与多达四个其他分子形成氢键,如图所示(两个通过它的两个孤对,两个通过它的两个氢原子)。
氢键强烈影响冰的晶体结构,有助于形成开放的六方晶格。在相同温度下,冰的密度小于水的密度;因此,与大多数其他物质不同,水的固相漂浮在液体上。液态水的高沸点是由于相对于其低分子量而言,每个分子可以形成大量氢键。
由于破坏这些键的难度,与其他类似液体未通过氢键结合的水相比,水具有非常高的沸点、熔点和粘度。水是独一无二的,因为它的氧原子有两个孤对原子和两个氢原子,这意味着一个水分子的键总数多达四个。液态水分子形成的氢键数量随时间和温度而波动。从25°C的TIP4P液态水模拟中,估计每个水分子平均参与3.59个氢键。
在100°C时,由于分子运动增加和密度降低,这个数字减少到3.24,而在0°C时,氢键的平均数量增加到3.69。另一项研究发现氢键的数量要少得多:25°C时为2.357。差异可能是由于使用了不同的方法来定义和计算氢键。
在键强度更相等的情况下,人们可能会发现两个相互作用的水分子的原子被分成两个带相反电荷的多原子离子,特别是氢氧化物(OH-)和水合氢(H3O+)。(水合氢离子也称为水合氢离子。)H−O−H3O+事实上,在标准温度和压力条件下的纯水中,后一种公式很少适用;根据这种条件下水的离解常数值,平均每5.5×108个分子中约有一个向另一个水分子放弃一个质子。
它是水独特性的重要组成部分。因为水可以与溶质质子供体和受体形成氢键,它可以竞争性地抑制溶质分子间或分子内氢键的形成。因此,溶解在水中的溶质分子之间或内部的氢键相对于水与这些溶质上氢键的供体和受体之间的氢键几乎总是不利的。水分子之间的氢键的平均寿命为10-11秒,即10皮秒。
水中的分叉和过配位氢键
一个氢原子可以参与两个氢键,而不是一个。这种类型的粘合称为分叉(分成两个或两个分叉)。例如,它可以存在于复杂的天然或合成有机分子中。有人提出,分叉的氢原子是水重新定向的重要步骤。受体型氢键(终止于氧的孤对电子)比供体型氢键更容易形成分叉(称为过配位氧,OCO),从相同的氧的氢开始。
其他液体
例如,氟化氢——在F原子上有三个孤对电子,但只有一个H原子——只能形成两个键;(氨有相反的问题:三个氢原子,但只有一对孤对原子)。H-F···H-F···H-F
溶剂氢键的进一步表现
- 许多化合物的熔点、沸点、溶解度和粘度的增加可以用氢键的概念来解释。
- HF和水的混合物的负共沸。
- 冰比液态水密度小的事实是由于氢键稳定的晶体结构。
- 与不存在氢键的较重的类似物PH3、H2S和HCl相比,NH3、H2O和HF的沸点显着提高。
- 无水磷酸和甘油的粘度。
- 羧酸中的二聚体形成和氟化氢中的六聚体形成,即使在气相中也会发生,导致与理想气体定律的严重偏差。
- 在非极性溶剂中形成水和醇的五聚体。
聚合物中的氢键
编辑氢键在确定许多合成和天然蛋白质所采用的三维结构和特性方面起着重要作用。与构成大多数聚合物的CC、CO和CN键相比,氢键要弱得多,可能只有5%。因此,氢键可以通过化学或机械方式断裂,同时保留聚合物骨架的基本结构。这种键强度等级(共价键强于氢键,强于范德华力)是理解许多材料特性的关键。
脱氧核糖核酸
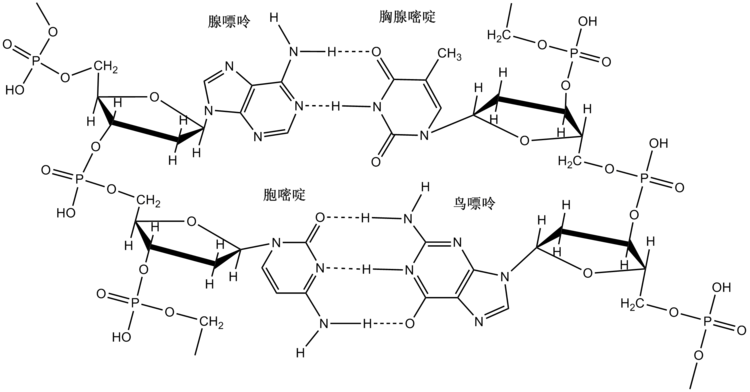
在这些大分子中,同一大分子各部分之间的键合使其折叠成特定的形状,这有助于确定分子的生理或生化作用。例如,DNA的双螺旋结构主要是由于其碱基对之间的氢键(以及pi堆叠相互作用),它将一条互补链与另一条互补链连接起来并实现复制。
蛋白质
在蛋白质的二级结构中,主链氧和酰胺氢之间形成氢键。当参与氢键的氨基酸残基的间距规则地出现在位置i和i+4之间时,就形成了一个α螺旋。当间距较小时,在位置i和i+3之间,形成310螺旋。当两条链通过氢键连接时,每条参与链上都有交替残基,形成了一个β折叠。
氢键还通过R基团的相互作用在形成蛋白质的三级结构中发挥作用。(另见蛋白质折叠)。分叉的氢键系统在α-螺旋跨膜蛋白中很常见,在作为氢键受体的残基i的骨架酰胺C=O和来自残基i+4的两个H键供体之间:骨架酰胺NH和侧链羟基或硫醇H+。
分叉的氢键羟基或硫醇系统的能量偏好分别为-3.4kcal/mol或-2.6kcal/mol。这种类型的分叉氢键为疏水膜环境中的极性侧链(例如丝氨酸、苏氨酸和半胱氨酸)提供了螺旋内的氢键配对物。
氢键在蛋白质折叠中的作用也与渗透压诱导的蛋白质稳定有关。保护性渗透剂,例如海藻糖和山梨糖醇,以浓度依赖性方式将蛋白质折叠平衡向折叠状态转移。
虽然对渗透物作用的普遍解释依赖于排除体积效应,这些效应本质上是熵的,但圆二色性(CD)实验表明渗透物通过焓效应起作用。
尽管已经提出了几种机制,但它们在蛋白质稳定中的作用的分子机制仍未完全确定。计算机分子动力学模拟表明,渗透剂通过改变蛋白质水合层中的氢键来稳定蛋白质。
多项研究表明,氢键对多聚体蛋白中亚基之间的稳定性起着重要作用。例如,对山梨糖醇脱氢酶的研究显示了一个重要的氢键网络,它可以稳定哺乳动物山梨糖醇脱氢酶蛋白家族中的四聚体四级结构。
不完全免受水攻击的蛋白质骨架氢键是脱水子。脱氢 (Dehydrons) 通过蛋白质或配体结合促进水的去除。外源脱水通过去屏蔽它们的部分电荷来增强酰胺和羰基之间的静电相互作用。
此外,脱水通过使由脱水的孤立电荷组成的非键态不稳定来稳定氢键。羊毛是一种蛋白质纤维,通过氢键结合在一起,导致羊毛在拉伸时回缩。然而,在高温下洗涤会永久性地破坏氢键,衣服可能会永久性地变形。
纤维素
氢键在纤维素和衍生聚合物的结构中很重要,在自然界中有许多不同的形式,例如棉花和亚麻。
合成聚合物
许多聚合物通过链内和链之间的氢键得到加强。在合成聚合物中,一个很好的例子是尼龙,其中氢键出现在重复单元中,并在材料的结晶中起主要作用。键发生在酰胺重复单元中的羰基和胺基之间。它们有效地连接相邻的链条,有助于加固材料。芳纶纤维的效果很好,其中氢键横向稳定了线性链。链轴沿纤维轴排列,使纤维非常坚硬和坚固。
氢键网络使天然和合成聚合物对大气中的湿度水平敏感,因为水分子可以扩散到表面并破坏网络。一些聚合物比其他聚合物更敏感。因此,尼龙比芳纶更敏感,尼龙6比尼龙11更敏感。
对称氢键
编辑对称氢键是一种特殊类型的氢键,其中质子恰好位于两个相同原子之间的中间。与这些原子中的每一个的键合强度是相等的。它是三中心四电子键的一个例子。这种键比普通的氢键强得多。有效键阶为0.5,因此其强度与共价键相当。它存在于高压冰中,也存在于许多无水酸如氢氟酸和甲酸的高压固相中。
在二氟化物离子[F–H–F]-中也可见。由于严格的空间约束,质子海绵的质子化形式(1,8-双(二甲氨基)萘)及其衍生物也具有对称的氢键([N–H–N]+),尽管在质子化的情况下ProtonSponge,组件弯曲。
双氢键
编辑氢键可以与密切相关的二氢键相比较,二氢键也是涉及氢原子的分子间键合相互作用。这些结构已为人所知一段时间,并通过晶体学很好地表征。
然而,对它们与常规氢键、离子键和共价键的关系的理解仍不清楚。通常,氢键的特征是质子受体,它是非金属原子中的孤对电子(最显着的是在氮和硫属元素基团中)。
在某些情况下,这些质子受体可能是pi键或金属络合物。然而,在二氢键中,金属氢化物充当质子受体,从而形成氢-氢相互作用。中子衍射表明,这些配合物的分子几何形状类似于氢键。
用光谱手段探测的动力学
编辑水中氢键结构的动力学可以通过OH伸缩振动的红外光谱进行探测。在质子有机离子塑料晶体(POIPCs)中的氢键网络中,POIPCs是一种在熔化前表现出固-固相变的相变材料,变温红外光谱可以揭示氢键的温度依赖性和动力学阴离子和阳离子。固-固相变过程中氢键的突然减弱似乎与离子取向或旋转紊乱的开始有关。
药物应用
编辑氢键是药物设计的关键。根据利平斯基 (Lipinski) 的五法则,大多数口服活性药物往往具有不超过五个氢键供体和少于十个氢键受体。这些相互作用存在于氮-氢和氧-氢中心之间。然而,多达一半的新药不遵守这些规则。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/151122/
