催化剂(英文名:catalyst)又称触媒,它泛指能够改变化学反应速率而本身的组成和性质在反应前后保持不变的元素或化合物。根据IUPAC在1981年提出的,催化剂是一种物质,它能够加速反应的速率而不改变该反应的标准吉布斯(Gibbs)自由焓[hán]变化。
相关历史
编辑中国在几千年前就通过发酵法即现今的酶催化法来酿制酒和醋。最早记载“催化现象”的资料可以追溯到16世纪末德国的《炼金术》一书,但当时“催化作用”还没有被作为一个化学概念。1746年约翰·罗巴克(J·Roebuck)在铅室法制造硫酸时,用NO作气相催化剂促使SO2氧化成SO3,才实现第一个现代工业催化过程。1781年安德烈·帕门蒂埃(Parmentier)发现无机酸可使淀粉催化水解成糖,1785年狄克曼(Diemann)用粘土使乙醇脱水,1817年汉弗里·戴维(Davy)用铂丝使矿井气燃烧。在之后的1832年,菲利普(Philips)发现可用铂作SO2转化成SO3的多相催化剂,并实现工业化。直至1835年,瑞典化学家延斯·雅各布·贝泽利乌斯(J.J.Berzelius)才在其著名的“二元学说”的基础上,把观察到的零星化学变化归结为是由一种“催化力”所引起的,并引入了“催化作用”一词。从此,对于催化作用的研究才广泛地开展起来,其进展推动着整个化学工业的发展,特别是对石油化工、煤化工、精细化工等产生了深远影响。1857年,狄肯(Deacon)法以CaCl2作催化剂使HCI氧化成氯,这是工业催化的一个重要里程碑。1877年傅瑞德尔-克拉夫茨(Friedel-Crafts)用AICI3使烃类缩合。在20世纪之前,工业催化剂还处在萌芽阶段,在化学工业生产中尚未显露出重要作用。进入20世纪后,工业催化剂才有了真正的发展。1902年诺曼(Normann)实现了用镍催化剂使脂肪加氢制硬化油的工业化生产。1905年弗里茨·哈伯(Haber)发现金属锇[é]、铀[yóu]及碳化铀对氨合成具较高催化活性,但锇易挥发而失活,铀则易被含氧化合物中毒。1909年卡尔博施(C.Bosch)选用铁为催化剂,经米塔希(AMittasch)改进后,终于在1913年在德国奥堡的BASF公司建厂,由氮与氢合成氨。1909年,德国化学家威廉·奥斯特瓦尔德(Wilhelm Ostwald)因对催化作用的研究工作和对化学平衡以及化学反应速率的基本原理的研究获得诺贝尔化学奖。第一次世界大战期间,德国因缺乏铂而又急需硝铵[ǎn]炸药,由米塔希(AMittasch)开发出铁铋催化剂代替铂作氨氧化催化剂,曾在BASF的奥堡工厂建造50座氧化炉。随着技术发展,为了减少对环境的破坏,环保催化剂开始研制,首先开发出排烟脱硫脱硝催化剂、硝酸尾气中NOx选择性与非选择性还原催化剂、内燃机排气及焚烧炉排气处理催化剂,1970年开发出汽车尾气处理的贵金属催化剂;1980年以后,工业催化剂达到成熟阶段,90%的化工过程都使用催化剂,催化剂也由使用厂商自行开发制造转向由专业公司承担,对催化剂性能要求更高;20世纪80年代起,催化剂生产公司间竞争日趋激烈,相互兼并之事时有发生。按不同的催化剂应用领域,少数大型催化剂生产公司控制了大部分世界催化剂市场份额。2021年,德国化学家本亚明·利斯特(Benjamin List)和美国化学家戴维·麦克米伦(David Mac Millan)因对不对称有机催化的研究获得诺贝尔化学奖。
定义演变
编辑最早定义催化剂的是德国化学家威廉·奥斯特瓦尔德(Ostwald),他认为催化剂是一种可以改变化学反应速度,而不存在于产物中的物质。在20世纪50年代以前,由于发现了一些物质可以终止自由基反应,有的物质可以降低催化剂的催化效应,因此有人提出了“负催化剂”的概念。化学发展的事实表明这种提法是不妥的。可以终止自由基反应的物质,往往是一种可以跟自由基结合或本身变成稳定自由基的物质。这种物质在反应前后的结构和性质都发生了改变,现在把它称为自由基的淬[cuì]灭剂或抑制剂。美国《不列颠百科全书》中关于催化剂和催化反应也有如下表述:能增加反应速率而其本身并不消耗的物质。为降低化学反应的速率向反应中添加的另外物质称为抑制剂,这种作用称为抑制或阻滞作用,有时也称为负催化反应。但因不被国际纯粹与应用化学联合会所接受。因此,20世纪60年代以后在科学界已经基本不再讨论“负催化剂”了。1981年,国际纯粹与应用化学联合会(IUPAC,International Union of PureAND Applied Chemistry)对催化剂的定义为:催化剂是一种物质,它能够改变化学反应的速率,而不改变该反应的标准吉布斯自由焓变化。现代对催化剂的定义是:催化剂是一种能够改变一个化学反应的反应速度,却不改变化学反应热力学平衡位置,本身在化学反应中不被明显地消耗的化学物质。催化作用是指催化剂对化学反应所产生的效应,涉及催化剂的反应称为催化反应。催化剂之所以具有如此大的实用性和适用性,是因为其具有最为重要的两个属性:
- 催化剂加速化学反应速度,使许多化学反应得以按工业规模进行,或显著改善了反应装置的温度和压力条件,从而提高了化工生产的经济效果。至于控制反应方向,本质上也是加速某一方向上的化学反应速度。
- 催化剂保持自身的化学性质不变,则使它在生产过程的一段期限内能不断地起催化作用,从而进一步提高了催化工业的经济效果。因此,提高催化剂加速化学反应速度的效能,延长催化剂实际使用的期限,始终是研制工业催化剂和设计催化反应工业装置的重点。
应用领域
编辑催化剂在无机化学领域、石油炼制领域、食品领域及环境保护领域中,催化剂已获得广泛应用。
无机化工领域
基础无机化学工业产品,品种不多,但产量相当大。其中以硫酸最具代表性,它是世界产量最大的合成化学品之一,1993年其世界产量约为1.37亿吨。硫酸的生产是以钒为催化剂氧化SO2而制得。硝酸的现代生产方法是在铂·佬催化剂的作用下,用氨的催化氧化法。合成氨工业对于世界农业的发展有重大意义,合成氨工业所用催化剂目前已有多种,包括加氢、脱硫、一段转化、二段转化、中温变换、低温变换、甲烷化及氨合成等8种以上不同过程的催化剂。
炼油领域
在石油炼制过程中,有许多催化加工过程,例如催化裂化、催化重整、加氢裂化、加氢精制、烷[wán]基化、异构化、烯烃叠合等,都是在特定的催化剂的作用下进行的。这些过程的产品收率、质量以及工艺技术、经济指标等都与催化剂的性能密切相关。这些过程的改进和发展,在一定程度上也与催化剂的改进和发展密切相关。
食品领域
食品酶制剂是用于食品加工,具有特殊催化功能的生物催化剂。它与一般的食品添加剂不同,作为一种加工助剂,仅在食品加工过程中起作用,加工过程中一旦完成其使命就消失或失去活力。由于食品酶制剂具有催化效率高、高度专一性、作用条件温和、降低能耗、减少化学污染等特点,随着食品工业的快速发展,食品酶制剂在食品工业中的应用越来越深入、广泛,在提升食品产业技术水平、促进新产品开发以及提高产品质量等方面发挥了重要作用。
环保领域
催化剂在环境保护领域中的应用随着世界人口的迅速增加和人类生产活动的日益强化,人类向地球排放的污染物已达到严重威胁人体健康的程度。环境保护问题已受到世界各国的普遍重视。由于催化方法能有效地保护环境,所以近年来在环境保护工程中,脱硫催化剂、经类氧化催化、氮氧化物净化催化剂、汽车尾气净化催化剂以及净化污水的酶(存在于微生物体内)催化剂等正在日益广泛地受到重视和应用。
作用机制
编辑催化剂在反应前后虽然数量和化学性质没有变化,但常常发现它的物理性质是变化了的,如粉末变成了块状、晶体大小的变化等。这说明催化剂是以某种形式参与了化学反应,形成能量较低的不稳定中间产物,然后再由中间产物进一步反应或本身分解,重新释放出催化剂并形成产物,改变了反应历程,降低了化学反应的活化能。下面以一个简单的化合反应为例,考察催化剂的作用机制。首先A和M化合,生成不太稳定的中间产物AM,然后AM和B进一步反应,生成AB,同时M得到再生,这两个反应的活化能分别为Ea1和EA2。
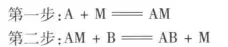 在没有使用催化剂时,反应的势能曲线如下图中曲线Ⅰ所示,反应的活化能是Ea。当加入催化剂M后,反应历程发生改变,按照曲线Ⅱ分两步进行。Ea1和Ea2均小于Ea,因此相比于原反应而言,这两个反应都进行得非常快,总反应速率也显著提高。
在没有使用催化剂时,反应的势能曲线如下图中曲线Ⅰ所示,反应的活化能是Ea。当加入催化剂M后,反应历程发生改变,按照曲线Ⅱ分两步进行。Ea1和Ea2均小于Ea,因此相比于原反应而言,这两个反应都进行得非常快,总反应速率也显著提高。
反应过程中的势能变化
类别
编辑化学催化剂
多相催化剂
多相催化是指反应物料所处的相态与催化剂不同。如气固催化、液固催化和气液固三相催化体系,其中催化剂多为固相。工业应用的固相催化剂按其作用原理分为四种类型:固体酸碱催化剂、金属催化剂、负载型过渡金属催化剂、过渡金属氧化物和硫化物催化剂。多相催化体系容易实现反应体系中催化剂的分离,工业生产中多采用固相催化剂。均相催化体系也有多相化的倾向。常见的多相催化剂有沸石、氧化铝、氧化镁、氢氧化钠、氢氧化钾、二氧化硅、石墨等。

分子筛催化剂
均相催化剂
均相催化剂和所催化的反应物料处于同一种相态——固态、液态或气态。均相催化剂主要包括Lewis酸、碱在内的酸碱催化剂和可溶性过渡金属化合物(或络合物)两大类,也有少数非金属分子作为均相催化剂,如I和NO等。均相催化剂在反应体系中以分子或离子的形式起催化作用。与多相催化剂相比,均相催化剂活性中心及其性质相对均一。如有机化合物的酸碱催化反应是通过正碳离子机理进行的。过渡金属化合物催化剂是通过络合作用使反应分子的基团活化,促进反应的进行。活性中心通过极化作用或形成络合着的自由基,使反应分子在配位上进行反应,即络合催化或配位催化。催化剂也可通过引发自由基产生而促进反应的进行。

加氢催化剂
生物催化剂
生物催化是通过生物酶的作用,在生物体内实现新陈代谢和能量转换。酶可在细胞内或细胞外起到催化作用。由此,酶经过培养和生成后可作为催化剂应用于特定的反应过程。生物酶催化剂的催化活性和选择性远高于化学催化剂。酶催化速率慢,针对特定反应过程的酶的培养和筛选,酶的生存环境等制约了酶的更大范围、更广领域的应用。生物催化剂所表现出来的良好性能,应对化学催化剂的研发起到启发和示范作用。
光催化剂
光催化剂就是在光子的激发下能够起到催化作用的化学物质的统称。世界上能作为光催化剂的材料众多,包括二氧化钛、氧化锌、氧化锡、二氧化锆、硫化镐等多种氧化物和硫化物半导体,其中二氧化钛因其氧化能力强、化学性质稳定、无毒,成为使用最广泛的纳米光触媒材料。

二氧化钛
电催化剂
电催化是使电极与电解质界面上的电荷转移反应得以加速的催化作用,可视为复相催化的一个分支。它的主要特点是电催化反应速度不仅由电催化剂的活性决定,还与双电层内电场及电解质溶液的本性有关。电催化剂与复相催化剂一样,要求对特定的电极反应有良好的催化活性、高选择性、还要求能耐受电解质的腐蚀,并有良好的导电性能。因此,在一段时间内,较为满意的电催化剂仅限于贵金属,如铂、钯及其合金。在开发与深入研究燃料电池的过程中,曾相继发现并重点研究了雷尼镍、硼化镍[niè]、碳化钨、钠钨青铜、尖晶石型与钙钛矿型半导体氧化物、各种晶间化合物、过渡金属与卟啉、酞化菁的配合物等电催化剂。

铂锭(左)和金锭(右)
性能
编辑活性
催化剂的活性,又叫催化活性,是催化剂加快化学反应速率的一种量度。换句话说,催化剂活性是指有催化剂存在时的反应速率与无催化剂存在时反应速率之差。相比之下,无催化剂存在时,反应速率极小,可忽略不计,所以催化活性实际上相当于有催化剂存在时的化学反应速率。催化剂的活性在不同的使用场合,有不同的表示方法:
- 时空产率。时空产率也称为催化剂的生产率,指在一定反应条件下,单位体积(或单位质量)的催化剂,单位时间内所得产品的量。
A表示催化剂的活性,kg产品/(h·kg催化剂);W表示产品产量,kg;WR表示催化剂质量,kg;T表示反应时间,h。
- 比活性。实验室中用比活性评价不同催化剂的活性,其定义是:
As为催化剂的比活性,kg/(h·m);S为催化剂的比表面,m/kg。
- 转化率。为了方便,常以某种主要反应物(以A表示)在给定反应条件下的转化百分率(简称转化率)直接表示催化剂的催化活性:
- 收率(单程收率)。收率是指在一定的反应条件下,某一反应物总量中变为某种产品的百分率:
- 转化频率(Turnover Frequency,TOF)表示在一定温度、压力、反应物比例和一定的反应程度下,单位时间内、单位活性位点上发生催化反应的次数或生成目标产物的数目或消耗反应物的数目,是表示催化反应速率的重要指标参数,TOF数值可反映催化剂的本征活性。在均相电化学反应中,TOF仅代表在反应扩散层中靠近电极表面催化剂的活性,与主体电解液中的催化剂无关。
I为电流;α为生成一分子目标产物时转移的电子数;F为法拉第常数;N为活性物质的摩尔数。
- 转化数(Turnover Number,TON)表示在一定温度、压力、反应物比例和一定的反应程度下,单位活性位点上发生催化反应的次数或生成目标产物的数目或消耗反应物的数目,是光(电)催化剂稳定性的量度,即在完全失活前,活性位点可以维持的转化数。
由于光催化剂的活性位点数通常难以确定,所以通常将反应电子数与光(电)催化剂原子数或光(电)催化剂表面原子数的比值用作TON的计算。反应电子数根据释放出产物的量计算获得。
活性单位
催化活性,符号z,单位名称katal(卡塔尔),符号kat。单位kat比较大,其实用的分数单位是mkat,μkat,nkat等。催化(活性)浓度,符号b,单位名称katalpercubicmeter(卡塔尔每立方米),符号kat/m。常用单位名称katalperlitre(卡塔尔每升),符号kat/L,其实用的分数单位是mkat/L、μkat/L、nkat/L等。质量催化活性,也称比催化活性,符号z/m,单位名称katalperkilogram(卡塔尔每千克),符号kat/kg,其实用的分数单位是mkat/g、μkat/g、nakat/g等。催化活性分数,符号zf,单位名称one(一),符号为1。至于酶活性的其他惯用单位,例如:AST,ACT有金氏单位、卡门氏单位等;碱性磷酸酶的“King-Armstrong”单位;ALP有金氏单位、鲍氏单位等——均应按与“U”的关系,先转换为“U”,再转换为“mol/s”,即“kat”。
选择性
若某反应物能同时发生几个不同的反应时,催化剂的选择性体现在某一种催化剂只能加速其中某一特定反应,而不能加速所有的反应。催化剂的选择性,在工业上具有特别重要的意义。例如:
- 在工业上,水煤气在不同的催化剂下进行合成反应,得到不同的产物:

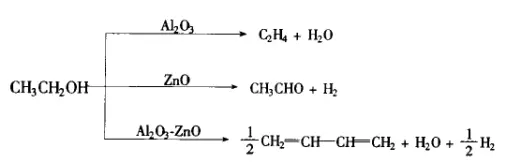
- 乙烯在不同的催化剂下进行氧化反应,得到不同的产物:
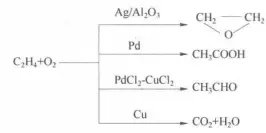 催化剂选择性的量度,通常用在一定条件下某种反应物的转化总量中转化为某种目的产品所用反应物的量占转化总量的百分比来表示:
催化剂选择性的量度,通常用在一定条件下某种反应物的转化总量中转化为某种目的产品所用反应物的量占转化总量的百分比来表示:
催化剂的选择性与活性是有关联但又相互独立的,它们分别来量度催化剂加速化学反应的两种不同效果,活性表示催化剂对提高产品产量的作用,而选择性表示了对提高原料利用率的作用。
稳定性
稳定性是标志催化剂在实际使用中活性衰退随使用时间变化的速度。在催化剂研制阶段,往往关心的是初活性和选择性,但对催化剂而言,稳定性与使用寿命是至关重要的。催化剂的稳定性包括耐热稳定性和抗毒稳定性两方面。导致催化剂活性衰退甚至失活的主要因素有:
- 催化剂表面析炭。由于氢解,聚合,环化或氢转移等反应而导致结焦,覆盖了活性中心,进而堵塞了催化剂的孔道,使活性表面丧失。
- 活性表面因吸附原料中所夹带的有害杂质。工业原料很难呈纯净的化学品,它们往往须经净化处理后才能用于催化反应。但催化剂对某些毒物十分敏感,往往浓度仅为μg/g或ng/g级的毒物也会导致催化剂的永久性中毒,特别是双金属负载型催化剂最易受选择性吸附中毒的影响。
- 活性组分的挥发、流失,负载活性金属烧结或微晶粒子长大都会使活性不可逆的衰退。通常操作温度超温至催化剂活性组分金属或金属氧化物熔点温度Tm的0.3倍(即0.3Tm)时开始发生晶格表面的迁移,当温度达到0.5Tm时开始发生晶格体相内的迁移。
- 化学物种对载体的侵蚀,以及载体孔结构的烧结导致孔道崩塌,催化剂强度丧失而失活。工业催化剂要求孔径分布合理,大孔有利于反应物与生成物的传质,而小孔有利于活性组分的均匀分散。
组成
编辑催化剂可由单一物质组成,也可由多种组分组成。工业运用的固相催化剂一般由主催化剂、共催化剂或助催化剂和载体三部分组成。
主催化剂
主催化剂又称为活性组分,是起催化作用的根本性物质。例如,在合成氨所用的催化剂Fe-K2O/Al2O3中,若没有K2O和A2lO3,则Fe虽然具有催化活性,但是其活性小,寿命短。相反,如果催化剂中没有Fe,则催化剂一点活性也没有。因此,Fe是活性组分。
共催化剂
有的催化剂的活性组分不止一种,而且能同时起催化作用,这种催化剂称为共催化剂(cocatalyst),又称为协同催化剂。例如,合成甲醇所用的催化剂CuO-ZnO/Al2O3,中,单独的CuO具有较好的活性,而单独的ZnO的活性则很小,但把两者组合起来却可制成活性很高的催化剂,所以ZnO是CuO的共催化剂,CuO是活性组分。
助催化剂
助催化剂又称为助剂,是提高活性组分的活性、选择性以及改善催化剂的耐热性、抗毒性、机械强度和寿命等性能的组分。助催化剂是本身不具活性或活性很小的物质,但只要添加少量到催化剂中,即可明显达到改进催化剂性能,根据助催化剂作用不同,通常可以分为结构助催化剂、电子助催化剂、晶格缺陷助催化剂以及选择性助催化剂。
载体
载体(Support)是活性组分的基底或黏合剂,它在催化剂中的主要作用有:改善催化剂的强度;改善导热和热稳定性;增大活性组分表面积和提供适宜的孔道结构;减少催化剂用量;为提供活性中心做出贡献;与活性组分发生强相互作用。
表征
编辑表面积
一般而言,催化剂表面积越大,其上所含有的活性中心越多,催化剂表面积大小直接影响催化活性高低。为了获得较高催化活性,常将催化剂制备成高度分散的多孔性颗粒,从而提供巨大的表面积。因此表面积是催化剂性质的重要表征指标之一,不仅要求催化剂表面积大,而且要求表面积稳定性高。通过比表面的测定,可预示出催化剂的催化活性,了解催化剂失活情况,判断活性衰退的可能原因是热烧结还是中毒。
孔结构
固体催化剂大多是多孔性物质,内部含有很多微孔,催化剂的催化性能和孔结构密切相关,主要表现在以下几个方面:
- 直接影响反应速率。
- 影响反应物和产物在孔中的扩散情况,催化剂表面利用率受到影响,影响反应速率。
- 影响到一系列的动力学参数以及选择性。
- 影响催化剂的选择性、寿命、机械强度、耐热性能等。因此,研究催化剂的孔结构对改善催化剂的性能、提高产率和选择性、改进催化剂应用有重要意义。
孔隙率
催化剂孔隙率是催化剂孔隙体积与整个颗粒体积之比。孔隙率大小决定着孔径和比表面大小,一般情况下,催化剂活性随孔隙率增大而升高,但机械强度随之而下降,较理想的孔隙率应在0.4~0.6之间。
孔容
孔容是催化剂内所有细孔体积的加和。孔容是表征催化剂孔结构的参量之一,常用比孔容表示。比孔容为1g催化剂颗粒内部所具有的孔体积由颗粒密度的倒数与骨架密度的倒数之差,可得到比孔容。
孔径分布与平均孔径
孔径的均匀分布会有效改善催化剂的活性和选择性。其原因是由反应物与产物在微孔中的扩散,即内扩散的速率所导致的。比如对于孔隙一致的分子筛,由于孔径分布均匀,内扩散速率相同,因此内扩散对速率的影响是一致的。但是绝大多数固体催化剂孔径范围分布非常广,孔径分布一般表示为孔体积对孔半径的平均变化率与孔半径的关系,也可表示成孔分布函数与孔半径的关系。通常采用气体吸附法测定中等孔范围的孔分布,汞孔度计法测定大孔范围的孔分布。对于孔径分布曲线是平滑曲线的催化剂,其孔径可用平均孔径r来代表,此为统计参量,可通过实验测定比孔体积V和比表面积S得到。
制备方法
编辑工业催化剂的制备方法很多。制备方法不同时,尽管选择的原料和用量完全一样,但所制得催化剂的性能仍可能差异很大。工业催化剂的制备方法主要有沉淀法、浸渍法、混合法、离子交换法、熔融法等。
沉淀法
沉淀法就是借助于沉淀反应,用沉淀剂(如碱类物质)将可溶性催化组分(金属盐类的水溶液)转化为难溶化合物,再经分离、洗涤、干燥、焙烧、成型等工序制得成品催化剂。沉淀法是制备固体催化剂最常用的方法之一,广泛用于制备高含量的非贵金属、金属氧化物、金属类催化剂或催化剂载体。其中沉淀法也有很多种,主要为:单组分沉淀法;共沉淀法;均匀沉淀法;超均匀沉淀法。
浸渍法
浸渍法是将载体放入有活性组分的溶液中浸泡(称为浸渍),浸渍平衡后取出载体,再经干燥、焙烧和活化,即可制得催化剂。浸渍法直接采用外购载体,处理量大,可以选择合适的载体。负载组分多数情况分布在载体的表面上,利用率高,用量少,成本低。此法更适用于低含量贵重金属负载型催化剂,但焙烧分解工序常产生废气污染。
混合法
混合法是工业上制备多组分固体催化剂常用方法。原理是将两种或多种催化剂组分,以粉末粒子在球磨机或碾压机上经机械混合后成型、干燥、焙烧、还原制得催化剂。混合的目的是促进物料间均匀分布,提高分散度。因此,在制备时应尽可能使各组分混合均匀。因为采取单纯的机械混合,所以混合法中组分间的分散度仍不及其他方法。
离子交换法
离子交换法是利用载体表面存在着可以进行交换的离子,将活性组分通过离子交换负载在载体上,再经过洗涤、还原等制成负载型金属催化剂。离子交换反应发生在载体表面固定而有限的交换基团与具有催化性能的离子之间,遵循化学计量关系,一般是可逆过程。离子交换法制得的催化剂的分散度较好、活性也较高。尤其适用于制备低含量、高利用率的贵金属催化剂。均相络合催化剂的固相化和沸石分子筛、离子交换树脂的改性过程也常采用这种过程。
熔融法
熔融法是在高温条件下进行催化剂组分的熔合,使之成为均匀的混合体、合金固溶体或氧化物固溶体。在熔融温度下金属和金属氧化物都呈流体状态,有利于组分间的均匀混合,从而促使助催化剂组分在主活性相上的分布,无论在晶相内或晶相间都达到高度分散,并以混晶或固溶体形态出现。其耗电量大、对电熔设备要求高,工艺有较大的局限性,通用性不大。
低温等离子体法
低温等离子体法在催化剂领域的应用主要表现在以下几个方面:直接合成超细颗粒催化剂、催化剂再生、催化剂表面处理、将活性组分沉淀到基体等,它们给催化剂制备技术注入了新的活力。利用等离子体技术制备的催化剂具有很多优点,如大比表面积、高分散性、无晶格缺陷、稳定性好等。等离子体技术制备催化剂主要有两种方式。其一为采用等离子体技术直接合成超细颗粒催化剂。另一种方式就是利用等离子体喷涂技术制备负载型催化剂。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/587224/
