动作电位
编辑在生理学中,当特定细胞位置的膜电位迅速上升和下降时,就会发生动作电位 (AP)。这种去极化然后导致相邻位置类似地去极化。动作电位发生在几种类型的动物细胞中,称为可兴奋细胞,包括神经元、肌肉细胞、内分泌细胞和一些植物细胞。
在神经元中,动作电位通过提供(或关于跳跃传导,协助)信号沿着神经元轴突向位于轴突末端的突触小结传播,在细胞间通讯中发挥核心作用。然后这些信号可以与突触处的其他神经元连接,或者连接到运动细胞或腺体。在其他类型的细胞中,它们的主要功能是激活细胞内过程。例如,在肌肉细胞中,动作电位是导致收缩的事件链中的第一步。在胰腺的β细胞中,它们会引起胰岛素的释放。神经元中的动作电位也称为神经冲动或尖峰,神经元产生的动作电位的时间序列称为其尖峰序列。发出动作电位或神经冲动的神经元,
动作电位是由嵌入细胞质膜中的特殊类型的电压门控离子通道产生的。当膜电位接近细胞的(负)静息电位时,这些通道会关闭,但如果膜电位增加到精确定义的阈值电压,它们会迅速开始打开,从而使跨膜电位去极化。当通道打开时,它们允许钠离子向内流动,从而改变电化学梯度,进而使膜电位进一步升高至零。然后,这会导致更多通道打开,从而在细胞膜上产生更大的电流,依此类推。该过程爆炸性地进行,直到所有可用的离子通道都打开,从而导致膜电位大幅上升。钠离子的快速流入导致质膜的极性反转,然后离子通道迅速失活。随着钠通道关闭,钠离子不能再进入神经元,然后它们被主动运回质膜。然后钾通道被激活,钾离子向外流动,使电化学梯度恢复到静止状态。动作电位发生后,会出现短暂的负移,称为后超极化。并且有钾离子的外流,使电化学梯度恢复到静止状态。动作电位发生后,会出现短暂的负移,称为后超极化。并且有钾离子的外流,使电化学梯度恢复到静止状态。动作电位发生后,会出现短暂的负移,称为后超极化。
在动物细胞中,有两种主要类型的动作电位。一种由电压门控钠通道产生,另一种由电压门控钙通道产生。基于钠的动作电位通常持续不到一毫秒,但基于钙的动作电位可能持续 100 毫秒或更长时间。在某些类型的神经元中,缓慢的钙尖峰为长时间快速发射的钠尖峰提供驱动力。另一方面,在心肌细胞中,最初的快速钠峰值提供了引发钙峰值快速发作的引物,然后产生肌肉收缩。
概述
编辑动物、植物和真菌中几乎所有的细胞膜都在细胞的外部和内部保持电压差,称为膜电位。动物细胞膜上的典型电压为 -70 mV。这意味着电池内部相对于外部具有负电压。在大多数类型的细胞中,膜电位通常保持相当恒定。然而,某些类型的电池具有电活性,因为它们的电压会随时间波动。在某些类型的电活性细胞中,包括神经元和肌肉细胞,电压波动经常以快速上升(正)尖峰然后快速下降的形式出现。这些上下循环被称为动作电位。在某些类型的神经元中,整个上下循环发生在千分之几秒内。在肌肉细胞中,典型的动作电位持续约五分之一秒。在一些其他类型的细胞和植物中,动作电位可能持续三秒或更长时间。
细胞的电特性由围绕它的膜的结构决定。细胞膜由脂质双层分子组成,其中嵌入了较大的蛋白质分子。脂质双层对带电离子的运动具有很强的抵抗力,因此它起到绝缘体的作用。相比之下,大的膜嵌入蛋白质提供离子可以穿过膜的通道。动作电位由通道蛋白驱动,通道蛋白的配置根据细胞内部和外部之间的电压差在关闭和打开状态之间切换。这些电压敏感蛋白被称为电压门控离子通道。
典型神经元中的过程
编辑动物体组织中的所有细胞都是电极化的——换句话说,它们在细胞的质膜上保持一个电压差,称为膜电位。这种电极化是由嵌入膜中的称为离子泵和离子通道的蛋白质结构之间复杂的相互作用引起的。在神经元中,膜中离子通道的类型通常在细胞的不同部分有所不同,从而赋予树突、轴突和细胞体不同的电特性。结果,神经元膜的某些部分可能是可兴奋的(能够产生动作电位),而其他部分则不是。最近的研究表明,神经元最易兴奋的部分是轴突小丘(轴突离开细胞体的点)之后的部分,称为轴突起始段,
每个可兴奋的膜片具有两个重要的膜电位水平:静息电位,即只要没有干扰细胞,膜电位就保持的值,以及称为阈值电位的更高值。在典型神经元的轴突小丘上,静息电位约为 –70 毫伏 (mV),阈值电位约为 –55 mV。神经元的突触输入导致膜去极化或超极化;也就是说,它们会导致膜电位上升或下降。当足够的去极化积累到使膜电位达到阈值时,动作电位被触发。当动作电位被触发时,膜电位会突然向上发射,然后同样突然向下发射,通常在低于静止水平时结束,并在此保持一段时间。动作电位的形状是千篇一律的;这意味着对于给定细胞中的所有动作电位,上升和下降通常具有大致相同的幅度和时间进程。(例外情况将在本文后面讨论)。在大多数神经元中,整个过程发生在大约千分之一秒内。许多类型的神经元以高达每秒 10-100 个的速率不断地发出动作电位。然而,有些类型更安静,可能会持续几分钟或更长时间而不会发出任何动作电位。许多类型的神经元以高达每秒 10-100 个的速率不断地发出动作电位。然而,有些类型更安静,可能会持续几分钟或更长时间而不会发出任何动作电位。许多类型的神经元以高达每秒 10-100 个的速率不断地发出动作电位。然而,有些类型更安静,可能会持续几分钟或更长时间而不会发出任何动作电位。
生物物理基础
编辑动作电位是由细胞膜中特殊类型的电压门控离子通道的存在引起的。电压门控离子通道是一种跨膜蛋白,具有三个关键特性:
- 它能够假设不止一种构象。
- 至少一种构象产生穿过膜的通道,该通道可渗透特定类型的离子。
- 构象之间的转变受膜电位的影响。
&nbSP;
因此,电压门控离子通道倾向于对某些膜电位值打开,而对其他值关闭。然而,在大多数情况下,膜电位和通道状态之间的关系是概率性的并且涉及时间延迟。离子通道在不可预知的时间在构象之间切换:膜电位决定了转变的速率和每单位时间每种转变类型的概率。
电压门控离子通道之所以能够产生动作电位,是因为它们可以产生正反馈回路:膜电位控制离子通道的状态,而离子通道的状态控制膜电位。因此,在某些情况下,膜电位的升高会导致离子通道打开,从而导致膜电位的进一步升高。当这个正反馈循环(霍奇金循环)爆炸性地进行时,就会出现动作电位。动作电位的时间和幅度轨迹由产生它的电压门控离子通道的生物物理特性决定。确实存在几种能够产生产生动作电位所需的正反馈的通道。电压门控钠通道负责神经传导中涉及的快速动作电位。肌肉细胞和某些类型的神经元中较慢的动作电位是由电压门控钙通道产生的。这些类型中的每一种都有多种变体,具有不同的电压灵敏度和不同的时间动态。
研究最深入的电压依赖性离子通道类型包括参与快速神经传导的钠通道。这些有时被称为 Hodgkin-Huxley 钠通道,因为 Alan Hodgkin 和 ANDrew Huxley 在他们获得诺贝尔奖的动作电位生物物理学研究中首次对它们进行了表征,但可以更方便地称为 NaV 通道。(V 代表电压。)NaV 通道具有三种可能的状态,称为停用、激活和停用。当通道处于激活状态时,该通道仅可透过钠离子。当膜电位低时,通道大部分时间处于失活(关闭)状态。如果膜电位升高到一定水平以上,则通道显示转换到激活(打开)状态的可能性增加。膜电位越高,激活的可能性就越大。一旦通道被激活,它最终将转换到非激活(关闭)状态。然后它往往会保持失活一段时间,但是,如果膜电位再次变低,通道最终将转变回失活状态。在动作电位期间,这种类型的大多数通道都会经历一个循环去激活→激活→去激活→去激活。然而,这只是总体平均行为——原则上,单个渠道可以随时进行任何转换。然而,通道从非激活状态直接转变为激活状态的可能性非常低:处于非激活状态的通道在其转变回非激活状态之前是难以控制的。
所有这一切的结果是 NaV 通道的动力学由一个过渡矩阵控制,其速率以复杂的方式依赖于电压。由于这些通道本身在确定电压方面发挥着重要作用,因此很难计算出系统的全局动态。霍奇金和赫胥黎通过为控制离子通道状态的参数开发一组微分方程来解决这个问题,称为霍奇金-赫胥黎方程。这些方程已被后来的研究广泛修改,但构成了大多数动作电位生物物理学理论研究的起点。
随着膜电位的增加,钠离子通道打开,使钠离子进入细胞。随后打开钾离子通道,使钾离子从细胞中排出。钠离子的向内流动增加了细胞中带正电的阳离子的浓度并引起去极化,其中细胞的电位高于细胞的静息电位。钠通道在动作电位的峰值处关闭,而钾继续离开细胞。钾离子的流出降低了膜电位或使细胞超极化。对于静息电压的小幅增加,钾电流超过钠电流,电压恢复到正常的静息值,通常为 -70 mV。然而,如果电压增加到超过临界阈值,通常比静息值高 15 mV,钠电流占主导地位。这会导致失控状态,钠电流的正反馈会激活更多的钠通道。因此,细胞放电,产生动作电位。神经元引发动作电位的频率通常称为放电率或神经放电率。
在动作电位过程中通过打开电压门控通道产生的电流通常明显大于初始刺激电流。因此,动作电位的幅度、持续时间和形状很大程度上取决于可兴奋膜的特性,而不是刺激的幅度或持续时间。动作电位的这种全有或全无的特性使其与分级电位(如受体电位、电渗电位、阈下膜电位振荡和突触电位)区分开来,这些电位随刺激的大小而变化。由电压门控通道、泄漏通道、通道分布、离子浓度、膜电容、温度、
参与动作电位的主要离子是钠和钾阳离子;钠离子进入细胞,钾离子离开,恢复平衡。相对较少的离子需要穿过膜以使膜电压发生剧烈变化。因此,在动作电位期间交换的离子对内部和外部离子浓度的变化可以忽略不计。少数穿过的离子通过钠钾泵的连续作用再次被泵出,钠钾泵与其他离子转运蛋白一起维持跨膜离子浓度的正常比例。钙阳离子和氯阴离子分别涉及几种类型的动作电位,例如心脏动作电位和单细胞藻类的动作电位。
虽然动作电位是在可兴奋膜片上局部产生的,但由此产生的电流可以触发相邻膜片上的动作电位,从而促成多米诺骨牌式的传播。与电位的被动传播(电张电位)相反,动作电位沿着可兴奋的膜延伸重新产生并传播而不会衰减。轴突的有髓部分是不可兴奋的并且不产生动作电位,并且信号作为电子电位被动传播。规则间隔的无髓斑块,称为 Ranvier 节点,产生动作电位以增强信号。这种类型的信号传播被称为跳跃传导,提供了信号速度和轴突直径的有利折衷。一般来说,轴突末端的去极化,触发神经递质释放到突触间隙。此外,在新皮质中普遍存在的锥体神经元的树突中记录了反向传播的动作电位。这些被认为在依赖于尖峰时间的可塑性中起作用。
在霍奇金-赫胥黎膜电容模型中,动作电位的传输速度是不确定的,假设相邻区域由于释放的离子干扰相邻通道而去极化。离子扩散和半径的测量表明这是不可能的。此外,熵变化和时间的矛盾测量结果对电容模型作为单独作用存在争议。或者,GilBERT Ling 的吸附假说假设活细胞的膜电位和动作电位是由于移动离子吸附到细胞的吸附位点上。
动作电位电特性的成熟
编辑神经元在发育过程中产生和传播动作电位变化的能力。电流脉冲导致神经元的膜电位变化多少是膜输入电阻的函数。随着细胞的生长,更多的通道被添加到膜上,导致输入电阻降低。成熟的神经元响应突触电流也会经历较短的膜电位变化。来自雪貂外侧膝状体核的神经元在 P0 处比在 P30 处具有更长的时间常数和更大的电压偏转。动作电位持续时间减少的一个后果是响应高频刺激可以保持信号的保真度。与高频刺激后的增强相比,未成熟的神经元更容易出现突触抑制。
在许多生物的早期发育过程中,动作电位实际上最初是由钙电流而不是钠电流来承载的。发育过程中钙通道的打开和关闭动力学比电压门控钠通道慢,后者将在成熟神经元中携带动作电位。钙通道较长的开放时间会导致动作电位比成熟神经元慢得多。非洲爪蟾神经元最初具有需要 60-90 毫秒的动作电位。在开发过程中,这个时间减少到 1 毫秒。这种急剧下降有两个原因。首先,内向电流主要由钠通道携带。其次,延迟整流器(钾通道电流)增加到其初始强度的 3.5 倍。
为了从依赖钙的动作电位转变为依赖钠的动作电位以进行新的通道必须添加到膜中。如果非洲爪蟾神经元在具有 RNA 合成或蛋白质合成抑制剂的环境中生长,那么这种转变就会被阻止。甚至细胞本身的电活动也可能在通道表达中起作用。如果非洲爪蟾肌细胞中的动作电位被阻断,钠和钾电流密度的典型增加就会被阻止或延迟。
这种电气特性的成熟可以在不同物种中看到。在神经元经历有丝分裂的最后阶段后,非洲爪蟾的钠和钾电流急剧增加。大鼠皮层神经元的钠电流密度在出生后的前两周内增加了 600%。
神经传递
编辑神经元的解剖
编辑几种类型的细胞支持动作电位,例如植物细胞、肌肉细胞和心脏的特化细胞(其中发生心脏动作电位)。然而,主要的可兴奋细胞是神经元,它也具有最简单的动作电位机制。
神经元是电兴奋细胞,通常由一个或多个树突、单个胞体、单个轴突和一个或多个轴突末端组成。树突是细胞投射,其主要功能是接收突触信号。它们的突起被称为树突棘,旨在捕获突触前神经元释放的神经递质。它们具有高浓度的配体门控离子通道。这些刺有一个细颈,将球状突起连接到树突。这确保了脊柱内部发生的变化不太可能影响相邻的脊柱。除了极少数例外(见 LTP),树突棘可以作为一个独立的单元。树突从容纳细胞核的胞体和许多正常的真核细胞器延伸出来。与刺不同,胞体表面由电压激活的离子通道组成。这些通道有助于传输由树突产生的信号。从胞体中出现的是轴突小丘。该区域的特点是具有非常高浓度的电压激活钠通道。一般来说,它被认为是动作电位的尖峰起始区,即触发区。脊椎处产生的多个信号,由体细胞传输的信号都汇聚于此。轴突小丘之后是轴突。这是一个远离胞体的细管状突起。轴突由髓鞘绝缘。髓磷脂由雪旺细胞(在外周神经系统中)或少突胶质细胞(在中枢神经系统中)组成,两者都是神经胶质细胞的类型。尽管神经胶质细胞不参与电信号的传输,但它们与神经元进行交流并为神经元提供重要的生化支持。具体来说,髓磷脂在轴突段周围缠绕多次,形成一层厚厚的脂肪层,防止离子进入或逸出轴突。这种绝缘可防止显着的信号衰减并确保更快的信号速度。然而,这种绝缘具有限制,即轴突表面上不能存在通道。因此,有规则间隔的膜片,它们没有绝缘。Ranvier 的这些节点可以被认为是迷你轴突小丘,因为它们的目的是增强信号以防止显着的信号衰减。在最远的一端,轴突失去绝缘并开始分支成几个轴突末端。
引发
编辑在考虑动作电位沿轴突的传播及其在突触旋钮处的终止之前,考虑在轴突小丘处启动动作电位的方法是有帮助的。基本要求是将小丘处的膜电压提高到触发阈值以上。有几种方式可以发生这种去极化。
动力学
编辑动作电位最常由突触前神经元的兴奋性突触后电位启动。通常,神经递质分子由突触前神经元释放。然后这些神经递质与突触后细胞上的受体结合。这种结合打开了各种类型的离子通道。该开口具有改变细胞膜的局部渗透性的进一步影响,从而改变膜电位。如果结合增加电压(使膜去极化),则突触是兴奋性的。然而,如果结合降低了电压(使膜超极化),则它是抑制性的。无论电压是增加还是减少,变化都会被动地传播到膜的附近区域(如电缆方程及其改进所描述的)。通常,电压刺激随着与突触的距离和与神经递质结合的时间呈指数衰减。部分兴奋性电压可能会到达轴突小丘,并且可能(在极少数情况下)使膜去极化足以激发新的动作电位。更典型的是,来自几个突触的兴奋性电位必须几乎同时协同工作以激发新的动作电位。然而,他们的共同努力可能会因抑制突触后电位的抑制而受阻。来自几个突触的兴奋性电位必须几乎同时协同工作才能激发新的动作电位。然而,他们的共同努力可能会因抑制突触后电位的抑制而受阻。来自几个突触的兴奋性电位必须几乎同时协同工作才能激发新的动作电位。然而,他们的共同努力可能会因抑制突触后电位的抑制而受阻。
神经传递也可以通过电突触发生。由于可兴奋细胞之间以间隙连接的形式直接连接,动作电位可以直接从一个细胞沿任一方向传递到下一个细胞。细胞间离子的自由流动使非化学介导的快速传输成为可能。整流通道确保动作电位通过电突触仅向一个方向移动。电突触存在于所有神经系统中,包括人脑,尽管它们是少数。
全有或全无原则
编辑动作电位的幅度与产生它的电流量无关。换句话说,更大的电流不会产生更大的动作电位。因此,动作电位被称为全有或全无信号,因为它们要么完全发生,要么根本不发生。这与受体电位相反,后者的幅度取决于刺激的强度。在这两种情况下,动作电位的频率都与刺激的强度相关。
感觉神经元
编辑在感觉神经元中,压力、温度、光或声音等外部信号与离子通道的打开和关闭相结合,进而改变膜的离子渗透性及其电压。这些电压变化可以再次是兴奋性(去极化)或抑制性(超极化),并且在一些感觉神经元中,它们的综合作用可以使轴突小丘去极化,足以激发动作电位。人类的一些例子包括嗅觉受体神经元和迈斯纳小体,它们分别对嗅觉和触觉至关重要。然而,并不是所有的感觉神经元都将其外部信号转化为动作电位。有些甚至没有轴突。相反,它们可以将信号转换为神经递质的释放,或转换为连续分级电位,其中任何一种都可能刺激随后的神经元激发动作电位。例如,在人耳中,毛细胞将传入的声音转换为机械门控离子通道的打开和关闭,这可能导致神经递质分子被释放。
起搏器电位
编辑在感觉神经元中,动作电位由外部刺激产生。然而,一些可兴奋的细胞不需要这样的刺激来激发:它们会自发地去极化它们的轴突小丘,并以规则的速率激发动作电位,就像内部时钟一样。这种细胞的电压轨迹被称为起搏器电位。心脏窦房结的心脏起搏器细胞就是一个很好的例子。这种起搏器电位虽然有自然节律,但可以通过外界刺激来调节;例如,心率可以通过药物以及来自交感神经和副交感神经的信号来改变。外部刺激不会引起细胞的重复放电,而只是改变它的时间。在某些情况下,频率的调节可能更复杂,导致动作电位的模式,例如爆发。
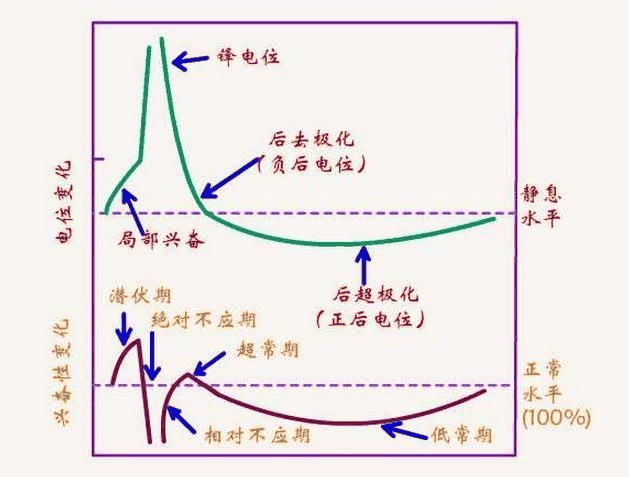
阶段
编辑动作电位的过程可分为五个部分:上升期、峰值期、下降期、下冲期和不应期。在上升阶段,膜电位去极化(变得更正)。去极化停止的点称为峰值相位。在这个阶段,膜电位达到最大值。在此之后,有一个下降阶段。在这个阶段,膜电位变得更负,回到静息电位。下冲或超极化后阶段是膜电位暂时变得比静止时(超极化)时更带负电的时期。最后,后续动作电位不可能或难以触发的时间称为不应期,
动作电位的过程由两个耦合效应决定。首先,电压敏感离子通道响应于膜电压 Vm 的变化而打开和关闭。这会改变膜对这些离子的渗透性。其次,根据 Goldman 方程,这种渗透性变化会改变平衡电位 Em,从而改变膜电压 Vm。因此,膜电位影响通透性,进而进一步影响膜电位。这为正反馈提供了可能性,这是动作电位上升阶段的关键部分。一个复杂的因素是单个离子通道可能有多个内部门,它们以相反的方式或以不同的速率响应 Vm 的变化。例如,虽然提高 Vm 会打开电压敏感钠通道中的大多数门,它还关闭了通道的失活门,尽管速度较慢。因此,当 Vm 突然升高时,钠通道最初打开,但由于失活较慢而关闭。
1952 年 Alan Lloyd Hodgkin 和 Andrew Huxley 准确地模拟了所有阶段动作电位的电压和电流,并因此获得了 1963 年的诺贝尔生理学或医学奖。然而,他们的模型只考虑了两种类型的电压敏感的离子通道,并对它们做出了一些假设,例如,它们的内部栅极相互独立地打开和关闭。实际上,离子通道有很多种,它们并不总是独立打开和关闭。
刺激和上升阶段
编辑典型的动作电位始于轴突小丘,具有足够强的去极化,例如增加 Vm 的刺激。这种去极化通常是由向细胞中注入额外的钠阳离子引起的;这些阳离子可以来自多种来源,例如化学突触、感觉神经元或起搏器电位。
对于静止的神经元,与细胞内液相比,细胞外液中的钠离子和氯离子浓度较高,而与细胞外液相比,细胞内液中的钾离子浓度较高。浓度差异导致离子从高浓度移动到低浓度,而静电效应(相反电荷的吸引)是离子进出神经元的原因。相对于细胞外部,神经元内部带有负电荷,这是由于 K+ 移动到细胞外。与其他离子相比,神经元膜对 K+ 的渗透性更高,从而使该离子能够选择性地移出细胞,降低其浓度梯度。这种浓度梯度以及存在于神经元膜上的钾泄漏通道导致钾离子流出,使静息电位接近 EK ≈ –75 mV。由于 Na+ 离子在细胞外的浓度较高,因此当 Na+ 通道打开时,浓度和电压差都会将它们驱入细胞中。去极化打开膜中的钠和钾通道,使离子分别流入和流出轴突。如果去极化很小(例如,将 Vm 从 -70 mV 增加到 -60 mV),则向外的钾电流压倒向内的钠电流,并且膜重新极化回到其在 -70 mV 左右的正常静息电位。但是,如果去极化足够大,内向钠电流比外向钾电流增加更多,并导致失控状态(正反馈):内向电流越多,Vm 增加越多,进而进一步增加内向电流。足够强的去极化(Vm 增加)导致电压敏感的钠通道打开;对钠的渗透性增加使 Vm 更接近钠平衡电压 ENa≈ +55 mV。增加的电压反过来导致更多的钠通道打开,这将 Vm 进一步推向 ENa。这种正反馈一直持续到钠通道完全打开并且 Vm 接近 ENa。Vm 和钠渗透性的急剧上升对应于动作电位的上升阶段。这反过来又进一步增加了内向电流。足够强的去极化(Vm 增加)导致电压敏感的钠通道打开;对钠的渗透性增加使 Vm 更接近钠平衡电压 ENa≈ +55 mV。增加的电压反过来导致更多的钠通道打开,这将 Vm 进一步推向 ENa。这种正反馈一直持续到钠通道完全打开并且 Vm 接近 ENa。Vm 和钠渗透性的急剧上升对应于动作电位的上升阶段。这反过来又进一步增加了内向电流。足够强的去极化(Vm 增加)导致电压敏感的钠通道打开;对钠的渗透性增加使 Vm 更接近钠平衡电压 ENa≈ +55 mV。增加的电压反过来导致更多的钠通道打开,这将 Vm 进一步推向 ENa。这种正反馈一直持续到钠通道完全打开并且 Vm 接近 ENa。Vm 和钠渗透性的急剧上升对应于动作电位的上升阶段。增加的电压反过来导致更多的钠通道打开,这将 Vm 进一步推向 ENa。这种正反馈一直持续到钠通道完全打开并且 Vm 接近 ENa。Vm 和钠渗透性的急剧上升对应于动作电位的上升阶段。增加的电压反过来导致更多的钠通道打开,这将 Vm 进一步推向 ENa。这种正反馈一直持续到钠通道完全打开并且 Vm 接近 ENa。Vm 和钠渗透性的急剧上升对应于动作电位的上升阶段。
这种失控条件的临界阈值电压通常约为 -45 mV,但这取决于轴突的近期活动。刚刚激发动作电位的细胞不能立即激发另一个细胞,因为 Na+ 通道尚未从失活状态中恢复。不能激发新动作电位的时期称为绝对不应期。在更长的时间里,在一些但不是所有离子通道恢复后,轴突可以被刺激产生另一个动作电位,但阈值更高,需要更强的去极化,例如,到 -30 mV。动作电位异常难以唤起的时期称为相对不应期。
高峰期
编辑随着钠离子通道最大程度地打开,上升阶段的正反馈减慢并停止。在动作电位的峰值,钠通透性最大,膜电压Vm几乎等于钠平衡电压ENa。然而,最初打开钠通道的同样升高的电压也会通过关闭它们的毛孔来缓慢地关闭它们。钠通道失活。这降低了膜对钠相对于钾的渗透性,使膜电压回到静息值。同时,升高的电压会打开电压敏感的钾通道;膜钾渗透性的增加使 Vm 向 EK 方向发展。结合起来,钠和钾通透性的这些变化导致 Vm 迅速下降,
后超极化
编辑去极化电压打开了额外的电压依赖性钾通道,当膜恢复到正常的静息电压时,其中一些通道不会立即关闭。此外,在动作电位期间响应钙离子的流入,进一步打开钾通道。钾离子的细胞内浓度暂时异常低,使膜电压 Vm 更接近钾平衡电压 EK。膜电位低于静息膜电位。因此,存在下冲或超极化,称为后超极化,持续到膜钾通透性恢复到其通常值,使膜电位恢复到静息状态。
不应期
编辑每个动作电位之后都有一个不应期,该不应期可分为绝对不应期,在此期间不可能唤起另一个动作电位,然后是相对不应期,在此期间需要比通常更强的刺激。这两个不应期是由钠和钾通道分子状态的变化引起的。当在动作电位后关闭时,钠通道进入失活状态,在这种状态下,无论膜电位如何,它们都无法打开——这产生了绝对不应期。即使在足够数量的钠通道转变回其静止状态后,仍然经常发生一小部分钾通道保持打开状态,从而使膜电位难以去极化,从而产生相对不应期。由于钾通道的密度和亚型在不同类型的神经元之间可能存在很大差异,因此相对不应期的持续时间是高度可变的。
绝对不应期主要负责动作电位沿轴突的单向传播。在任何给定时刻,主动尖峰部分后面的轴突斑块是难治的,但前面的斑块最近没有被激活,能够被动作电位的去极化刺激。
传播
编辑在轴突小丘处产生的动作电位沿轴突以波的形式传播。在动作电位期间,在轴突上的一点向内流动的电流沿轴突扩散,并使其膜的相邻部分去极化。如果足够强,这种去极化会在相邻的膜片上引起类似的动作电位。这一基本机制由 Alan Lloyd Hodgkin 在 1937 年证明。在压碎或冷却神经节段并因此阻断动作电位后,他证明到达阻断一侧的动作电位可以在另一侧引起另一个动作电位,前提是阻塞段足够短。
一旦在膜片上发生动作电位,膜片需要时间恢复才能再次触发。在分子水平上,这个绝对不应期对应于电压激活的钠通道从失活中恢复所需的时间,即返回到它们的闭合状态。神经元中有多种电压激活的钾通道。它们中的一些快速失活(A型电流),其中一些缓慢失活或根本不失活;这种可变性保证了总是有可用的复极化电流源,即使某些钾通道由于先前的去极化而失活。另一方面,在强去极化过程中,所有神经元电压激活的钠通道都会在几毫秒内失活,因此,在大部分钠通道恢复到关闭状态之前,不可能进行后续去极化。虽然它限制了发射频率,但绝对不应期确保动作电位沿轴突仅在一个方向上移动。由于动作电位而流入的电流沿轴突向两个方向扩散。然而,只有轴突未激发的部分才能产生动作电位。刚刚发射的部分没有反应,直到动作电位安全超出范围并且无法重新刺激该部分。在通常的顺向传导中,动作电位从轴突小丘向突触结(轴突末端)传播;反向传播——称为逆行传导——是非常罕见的。然而,如果实验室轴突在其中间受到刺激,则轴突的两半都是新鲜的,即未触发;然后将产生两个动作电位,一个向轴突小丘移动,另一个向突触旋钮移动。
髓鞘和跳跃传导
编辑为了能够在神经系统中快速有效地传导电信号,某些神经元轴突被髓鞘覆盖。髓磷脂是一种多层膜,将轴突包裹在由称为 Ranvier 节点的间隔分开的部分中。它由专门的细胞产生:仅在外周神经系统中的雪旺细胞和仅在中枢神经系统中的少突胶质细胞。髓鞘降低膜电容并增加节点间间隔的膜电阻,从而允许动作电位从节点到节点的快速、跳跃运动。髓鞘形成主要存在于脊椎动物中,但在少数无脊椎动物中也发现了类似的系统,例如某些虾类。并非脊椎动物的所有神经元都有髓鞘。例如,
髓鞘阻止离子沿有髓鞘节段进入或离开轴突。作为一般规则,髓鞘形成会增加动作电位的传导速度并使其更节能。无论是否跳跃,动作电位的平均传导速度范围从每秒 1 米 (m/s) 到超过 100 m/s,并且通常随着轴突直径的增加而增加。
动作电位不能通过轴突有髓节段的膜传播。然而,电流由细胞质携带,足以使 Ranvier 的第一个或第二个后续节点去极化。相反,来自 Ranvier 一个节点的动作电位的离子电流会在下一个节点引发另一个动作电位。这种从节点到节点的明显的动作电位跳跃被称为跳跃传导。尽管跳跃式传导的机制在 1925 年由 Ralph Lillie 提出,但跳跃式传导的第一个实验证据来自 Ichiji Tasaki 和 Taiji Takeuchi,以及来自 Andrew Huxley 和 Robert Stämpfli。相比之下,在无髓轴突中,动作电位会在紧邻的膜中激发另一个动作电位,并像波浪一样沿着轴突连续移动。
髓磷脂有两个重要优点:传导速度快和能量效率高。对于大于最小直径(大约 1 微米)的轴突,髓鞘形成会增加动作电位的传导速度,通常是十倍。相反,对于给定的传导速度,有髓纤维比无髓纤维要小。例如,动作电位在有髓青蛙轴突和无髓乌贼巨轴突中以大致相同的速度 (25 m/s) 移动,但青蛙轴突的直径大约小 30 倍,横截面积小 1000 倍. 此外,由于离子电流被限制在 Ranvier 的节点上,因此穿过膜泄漏的离子要少得多,从而节省了代谢能量。这种节省是一个显着的选择优势,因为人类神经系统使用了大约 20% 的身体代谢能量。
轴突有髓节段的长度对跳跃传导的成功很重要。它们应该尽可能长,以最大限度地提高传导速度,但不要太长,以免到达的信号太弱而无法在 Ranvier 的下一个节点引发动作电位。在自然界中,有髓节通常足够长,以使被动传播的信号至少传播两个节点,同时保持足够的幅度以在第二个或第三个节点处激发动作电位。因此,跳跃式传导的安全系数很高,可以在受伤的情况下绕过节点传输。然而,动作电位可能在某些安全系数较低的地方过早结束,即使在无髓神经元中也是如此;一个常见的例子是轴突的分支点,它分为两个轴突。
一些疾病会降解髓鞘并损害跳跃传导,从而降低动作电位的传导速度。其中最著名的是多发性硬化症,其中髓磷脂的破坏会损害协调运动。
终止
编辑化学突触
编辑一般来说,到达突触结的动作电位会导致神经递质被释放到突触间隙中。神经递质是可以在突触后细胞中打开离子通道的小分子;大多数轴突在其所有末端都具有相同的神经递质。动作电位的到来打开了突触前膜中对电压敏感的钙通道;钙的流入导致充满神经递质的囊泡迁移到细胞表面并将其内容物释放到突触间隙中。这一复杂过程被神经毒素破伤风痉挛和肉毒杆菌毒素抑制,它们分别导致破伤风和肉毒杆菌中毒。
电突触
编辑一些突触省去了神经递质的中间环节,将突触前和突触后细胞连接在一起。当动作电位达到这样的突触时,流入突触前细胞的离子电流可以穿过两个细胞膜的屏障,并通过称为连接子的孔进入突触后细胞。因此,突触前动作电位的离子电流可以直接刺激突触后细胞。电突触允许更快的传输,因为它们不需要神经递质在突触间隙中缓慢扩散。因此,只要快速反应和时间协调至关重要,就可以使用电突触,例如逃避反射、脊椎动物的视网膜和心脏。
神经肌肉接头
编辑化学突触的一个特例是神经肌肉接头,其中运动神经元的轴突终止于肌纤维。在这种情况下,释放的神经递质是乙酰胆碱,它与乙酰胆碱受体结合,乙酰胆碱受体是肌纤维膜(肌膜)中的一种完整膜蛋白。然而,乙酰胆碱不会保持结合;相反,它解离并被位于突触中的酶乙酰胆碱酯酶水解。这种酶可以迅速减少对肌肉的刺激,从而可以精细地调节肌肉收缩的程度和时间。一些毒物使乙酰胆碱酯酶失活以防止这种控制,例如神经毒剂沙林和塔崩,以及杀虫剂二嗪农和马拉硫磷。
其他细胞类型
编辑心脏动作电位
编辑心脏动作电位与神经元动作电位的区别在于具有延长的平台期,在平台期中,膜在像往常一样被钾电流复极化之前保持在高电压数百毫秒。这个平台是由于较慢的钙通道打开并将膜电压保持在其平衡电位附近的作用,即使在钠通道失活之后也是如此。
心脏动作电位在协调心脏收缩中起重要作用。窦房结的心脏细胞提供使心脏同步的起搏器电位。这些细胞的动作电位传播到并通过房室结(房室结),房室结通常是心房和心室之间的唯一传导通路。来自 AV 结的动作电位穿过希氏束,然后到达浦肯野纤维。相反,心脏动作电位的异常——无论是由于先天性突变还是损伤——都会导致人类疾病,尤其是心律失常。几种抗心律失常药物作用于心脏动作电位,如奎尼丁、利多卡因、β受体阻滞剂和维拉帕米。
肌肉动作电位
编辑正常骨骼肌细胞中的动作电位与神经元中的动作电位相似。动作电位是由细胞膜(肌膜)的去极化引起的,这会打开电压敏感的钠通道;这些变得失活,并且膜通过钾离子的向外电流重新极化。动作电位之前的静息电位通常为 -90mV,比典型的神经元稍微负一些。肌肉动作电位持续约 2-4 ms,绝对不应期约 1-3 ms,沿肌肉的传导速度约 5 m/s。动作电位释放钙离子,释放原肌球蛋白并让肌肉收缩。突触前神经元动作电位到达神经肌肉接头会激发肌肉动作电位,
植物动作电位
编辑植物和真菌细胞也是电兴奋的。与动物动作电位的根本区别在于,植物细胞的去极化不是通过吸收正钠离子来完成,而是通过释放负氯离子来完成。1906 年,JC Bose 发表了对植物动作电位的第一次测量,这在之前是由 Burdon-Sanderson 和 Darwin 发现的。细胞质钙离子的增加可能是阴离子释放到细胞中的原因。这使得钙成为离子运动的前兆,例如在大麦叶中看到的负氯离子流入和正钾离子流出。
钙离子的初始流入也造成了小的细胞去极化,导致电压门控离子通道打开,并允许氯离子传播完全去极化。
一些植物(例如捕蝇草)使用钠门控通道来操作运动并基本上计数。捕蝇草,也称为捕蝇草,在北卡罗来纳州和南卡罗来纳州的亚热带湿地中发现。当土壤养分贫乏时,捕蝇草依靠昆虫和动物为食。尽管对该植物进行了研究,但对捕蝇草和一般食肉植物的分子基础缺乏了解。
然而,已经对动作电位以及它们如何影响捕蝇草内的运动和发条进行了大量研究。首先,捕蝇草的静息膜电位 (-120mV) 低于动物细胞 (通常为 -90mV 至 -40mV)。较低的静息电位更容易激活动作电位。因此,当昆虫落在植物的陷阱上时,它会触发一个类似毛发的机械感受器。然后该受体激活持续约 1.5 毫秒的动作电位。最终,这会导致进入细胞的正钙离子增加,使其轻微去极化。
但是,捕蝇草不会在一次触发后关闭。相反,它需要激活 2 根或更多根头发。如果只触发一根头发,它会将激活视为误报。此外,必须在特定时间间隔 (0.75 s – 40 s) 内激活第二根头发,才能将其注册到第一次激活。因此,钙的积累开始并从第一次触发开始缓慢下降。当在该时间间隔内触发第二个动作电位时,它会达到钙阈值以使细胞去极化,从而在几分之一秒内关闭对猎物的陷阱。
与随后释放的正钾离子一起,植物中的动作电位涉及盐(KCl)的渗透损失。然而,动物动作电位是渗透中性的,因为等量的进入钠和离开钾在渗透上相互抵消。植物细胞中电和渗透关系的相互作用似乎是由于盐度条件变化下动植物的普通单细胞祖先的电兴奋性的渗透功能引起的。此外,目前的快速信号传输功能被视为后生动物细胞在更稳定的渗透环境中的新成就。一些维管植物(例如含羞草)中熟悉的动作电位信号功能可能独立于后生动物可兴奋细胞中的信号功能。
与上升阶段和峰值不同,下降阶段和超极化后似乎主要取决于不是钙的阳离子。为了启动复极化,细胞需要通过膜上的被动运输将钾移出细胞。这与神经元不同,因为钾的运动并不主导膜电位的降低。事实上,为了完全复极化,植物细胞需要 ATP 形式的能量来帮助从细胞中释放氢——利用一种通常称为 H+-ATP 酶的转运蛋白。
分类分布和进化优势
编辑动作电位存在于多细胞生物中,包括植物、昆虫等无脊椎动物,以及爬行动物和哺乳动物等脊椎动物。海绵似乎是不传递动作电位的多细胞真核生物的主要门,尽管一些研究表明这些生物也具有某种形式的电信号。静息电位以及动作电位的大小和持续时间并没有随着进化而变化很大,尽管传导速度确实随着轴突直径和髓鞘形成而显着变化。
鉴于其在整个进化过程中的保守性,动作电位似乎赋予了进化优势。动作电位的一个功能是生物体内的快速、远程信号传导。传导速度可以超过110 m/s,是声速的三分之一。作为比较,血液中携带的激素分子在大动脉中以大约 8 m/s 的速度移动。该功能的一部分是机械事件的紧密协调,例如心脏收缩。第二个功能是与其生成相关的计算。作为不随传输距离衰减的全有或全无信号,动作电位具有与数字电子学类似的优势。
生活在大约 40 亿年前的共同原核/真核祖先被认为具有电压门控通道。这个功能很可能在稍后的某个时间点,用于提供一种通信机制。即使是现代单细胞细菌也可以利用动作电位与同一生物膜中的其他细菌进行交流。
实验方法
编辑动作电位的研究需要开发新的实验方法。1955 年之前的最初工作主要由 Alan Lloyd Hodgkin 和 Andrew Fielding Huxley 完成,他们与 John Carew Eccles 一起获得了 1963 年诺贝尔生理学或医学奖,以表彰他们对描述神经离子基础的贡献传导。它专注于三个目标:从单个神经元或轴突中分离信号,开发快速、灵敏的电子设备,以及将电极缩小到足以记录单个细胞内的电压。
第一个问题是通过研究在鱿鱼(Loligo forbesii 和 Doryteuthis pealeii,当时归类为 Loligo pealeii)神经元中发现的巨大轴突来解决的。这些轴突的直径非常大(大约 1 毫米,或比典型神经元大 100 倍),肉眼可以看到它们,因此很容易提取和操作。然而,它们并不代表所有可兴奋细胞,并且已经研究了许多其他具有动作电位的系统。
第二个问题通过电压钳的关键发展得到解决,它允许实验者单独研究动作电位下的离子电流,并消除了电子噪声的一个关键来源,即与膜电容 C 相关的电流 IC。由于电流等于跨膜电压 Vm 变化率的 C 倍,因此解决方案是设计一个电路,使 Vm 保持固定(零变化率),而不管流过膜的电流如何。因此,将 Vm 保持在固定值所需的电流是流过膜的电流的直接反映。其他电子进步包括使用法拉第笼和具有高输入阻抗的电子设备,因此测量本身不会影响被测量的电压。
第三个问题,即获得足够小的电极以在不干扰单个轴突内记录电压的问题,于 1949 年随着玻璃微量移液管电极的发明而得到解决,该电极很快被其他研究人员采用。这种方法的改进能够产生细至 100 Å (10 nm) 的电极尖端,这也具有高输入阻抗。动作电位也可以通过放置在神经元旁边的小金属电极、包含 EOSFET 的神经芯片或对 CA2+ 或电压敏感的染料进行光学记录。
虽然玻璃微量移液管电极测量通过许多离子通道的电流总和,但随着 Erwin Neher 和 Bert Sakmann 开发的膜片钳,在 1970 年代研究单个离子通道的电特性成为可能。由于这一发现,他们获得了 1991 年的诺贝尔生理学或医学奖。膜片钳验证了离子通道具有离散的电导状态,例如打开、关闭和失活。
近年来,人们开发了光学成像技术来测量动作电位,无论是通过同时多点记录还是超空间分辨率。使用电压敏感染料,已经从一小块心肌细胞膜上光学记录了动作电位。
神经毒素
编辑几种天然和合成的神经毒素旨在阻断动作电位。来自河豚的河豚毒素和来自 Gonyaulax(负责赤潮的甲藻属)的石房蛤毒素通过抑制电压敏感的钠通道来阻断动作电位;同样,来自黑曼巴蛇的树突毒素抑制电压敏感的钾通道。这种离子通道抑制剂具有重要的研究目的,允许科学家随意关闭特定通道,从而隔离其他通道的贡献;它们还可用于通过亲和色谱法纯化离子通道或测定它们的浓度。然而,这些抑制剂也能产生有效的神经毒素,并已被考虑用作化学武器。针对昆虫离子通道的神经毒素已成为有效的杀虫剂;一个例子是合成氯菊酯,它可以延长参与动作电位的钠通道的激活。昆虫的离子通道与人类的离子通道有很大的不同,因此对人类的副作用很少。
动作电位的历史
编辑电流在动物神经系统中的作用首先是由 Luigi Galvani 在解剖的青蛙中观察到的,他于 1791 年至 1797 年间对其进行了研究。Galvani 的研究结果刺激了亚历山德罗·沃尔塔(Alessandro Volta)开发伏打电堆——他研究的最早的电池。动物电(如电鳗)和对施加直流电压的生理反应。
19 世纪的科学家研究了电信号在整个神经(即神经元束)中的传播,并证明神经组织是由细胞组成的,而不是由相互连接的管网络(网状结构)组成。Carlo Matteucci 跟进了 Galvani 的研究,并证明细胞膜上有电压,可以产生直流电。Matteucci 的工作启发了德国生理学家 Emil du Bois-Reymond,他于 1843 年发现了动作电位。1850 年,du Bois-Reymond 的朋友 Hermann von Helmholtz 首次测量了动作电位的传导速度。为了确定神经组织是由离散细胞组成的,西班牙医生 Santiago Ramón y Cajal 和他的学生使用了由 Camillo GoLGi 开发的染色剂来揭示神经元的无数形状,他们煞费苦心地呈现出来。由于他们的发现,高尔基和拉蒙·卡哈尔获得了 1906 年的诺贝尔生理学奖。他们的工作解决了 19 世纪神经解剖学中长期存在的争议。高尔基本人曾主张神经系统的网络模型。
20 世纪是电生理学的重要时代。1902 年和 1912 年,Julius Bernstein 提出了动作电位是由轴突膜对离子的通透性变化引起的假设。伯恩斯坦的假设得到了肯科尔和霍华德柯蒂斯的证实,他们表明在动作电位期间膜电导增加。1907 年,路易斯·拉皮克 (Louis Lapicque) 提出动作电位是在超过阈值时产生的,后来将其显示为离子电导动力学系统的产物。1949 年,Alan Hodgkin 和 Bernard Katz 改进了 Bernstein 的假设,认为轴突膜对不同离子可能具有不同的渗透率;特别是,他们证明了钠通透性对动作电位的关键作用。他们首次实际记录了介导动作电位的神经元膜上的电变化。这一系列研究在 Hodgkin、Katz 和 Andrew Huxley 的 1952 年的五篇论文中达到顶峰,他们在其中应用电压钳技术来确定轴突膜对钠和钾离子的渗透性对电压和时间的依赖性,从中他们能够定量重建动作电位。Hodgkin 和 Huxley 将他们的数学模型的属性与离散的离子通道相关联,这些离子通道可能以几种不同的状态存在,包括打开、关闭和失活。Erwin Neher 和 Bert Sakmann 在 1970 年代中期和 1980 年代证实了他们的假设,他们开发了膜片钳技术来检查单个离子通道的电导状态。
Julius Bernstein 也是第一个引入 Nernst 方程来计算跨膜静息电位的人。David E. Goldman 在 1943 年将其推广到同名的 Goldman 方程。钠钾泵于 1957 年被确定,其性质逐渐被阐明,最终通过 X 射线晶体学确定其原子分辨率结构。相关离子泵的晶体结构也得到了解决,从而更广泛地了解了这些分子机器的工作原理。
定量模型
编辑数学和计算模型对于理解动作电位至关重要,并提供可以根据实验数据进行测试的预测,从而对理论进行严格的测试。早期神经模型中最重要和最准确的是 Hodgkin-Huxley 模型,它通过一组耦合的四个常微分方程 (ODE) 来描述动作电位。虽然霍奇金-赫胥黎模型与自然界中存在的真实神经膜相比可能是一种简化,几乎没有限制,但它的复杂性激发了一些更加简化的模型,例如莫里斯-勒卡模型和菲茨休-南云模型,两者都只有两个耦合 ODE。Hodgkin-Huxley 和 FitzHugh-Nagumo 模型及其相关模型的属性,例如 Bonhoeffer-Van der Pol 模型,在数学、计算和电子学领域得到了很好的研究。然而,发电机电位和动作电位的简单模型无法准确地再现接近阈值的神经尖峰率和尖峰形状,特别是对于像 Pacinian 小体这样的机械感受器。更现代的研究集中在更大、更集成的系统上;通过将动作电位模型与神经系统其他部分(例如树突和突触)的模型相结合,研究人员可以研究神经计算和简单的反射,例如逃逸反射和其他由中央模式发生器控制的反射。专门针对像 Pacinian 小体这样的机械感受器。更现代的研究集中在更大、更集成的系统上;通过将动作电位模型与神经系统其他部分(例如树突和突触)的模型相结合,研究人员可以研究神经计算和简单的反射,例如逃逸反射和其他由中央模式发生器控制的反射。专门针对像 Pacinian 小体这样的机械感受器。更现代的研究集中在更大、更集成的系统上;通过将动作电位模型与神经系统其他部分(例如树突和突触)的模型相结合,研究人员可以研究神经计算和简单的反射,例如逃逸反射和其他由中央模式发生器控制的反射。
内容由匿名用户提供,本内容不代表vibaike.com立场,内容投诉举报请联系vibaike.com客服。如若转载,请注明出处:https://vibaike.com/144808/
